
| A�� | ԭ�Ӱ뾶��Y��X�����Ӱ뾶Z��W | |
| B�� | Ԫ��Y�ĵ�������Ԫ��X�������������û���Ӧ | |
| C�� | Ԫ��Y��W���γ�YW2�����ӻ����� | |
| D�� | W�ĵ����ж�����ʹʪ�����ɫ������ɫ |
���� ����������Ԫ��X��Y��Z��W��ԭ��������������Zԭ��������������Xԭ���ڲ��������3����Ҳ��Yԭ��������������3��������������������8����K�㲻����2������X�ڲ��������2������Xλ�ڵڶ����ڣ�Y��Zλ�ڵ������ڣ���ZΪSԪ�أ�Y����������Ϊ2���Ҵ��ڵ������ڣ�ΪMgԪ�أ�������Ԫ��ԭ�ӵ�����������֮��Ϊ12��Y��Z����������֮��Ϊ8������X����������Ϊ4����XΪCԪ�أ�W ��ԭ����������S������WΪCl���ݴ˽��
��� �⣺����������Ԫ��X��Y��Z��W��ԭ��������������Zԭ��������������Xԭ���ڲ��������3����Ҳ��Yԭ��������������3��������������������8����K�㲻����2������X�ڲ��������2������Xλ�ڵڶ����ڣ�Y��Zλ�ڵ������ڣ���ZΪSԪ�أ�Y����������Ϊ2���Ҵ��ڵ������ڣ�ΪMgԪ�أ�������Ԫ��ԭ�ӵ�����������֮��Ϊ12��Y��Z����������֮��Ϊ8������X����������Ϊ4����XΪCԪ�أ�W ��ԭ����������S������WΪCl��
A�����Ӳ�Խ�࣬�뾶Խ�����Ų���ͬʱ��ԭ������Խ�����Ӱ뾶ԽС������ԭ�Ӱ뾶��Mg��C�����Ӱ뾶��S2-��Cl-����A����
B��Mg�������̼��Ӧ����C��MgO����B��ȷ��
C��Ԫ��Mg��Cl���γ�MgCl2�����ӻ������C��ȷ��
D�����������ж����壬��ʹʪ�����ɫ������ɫ����D��ȷ��
��ѡA��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã��ƶ�Ԫ���ǽ���ؼ�����Ҫѧ���������պ�������Ų������ؿ�������ƶ�������Ԫ�ػ�����֪ʶ���Ѷ��еȣ�


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
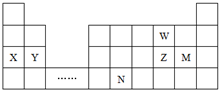
| A�� | ԭ�Ӱ뾶��Y��Z��W | |
| B�� | ���ʵĻ�ԭ�ԣ�X��Y | |
| C�� | ����Ԫ��Mͬ���壬����������ˮ��������Ա�M��ǿ | |
| D�� | Ԫ��Nλ�ڽ�����ǽ����ķֽ��߸����������ƶ�NԪ�صĵ��ʿ����뵼����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
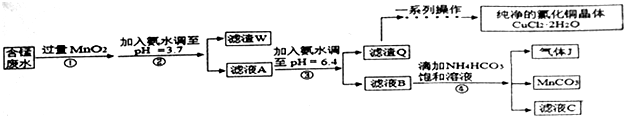
| �������� | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| ��ʼ������pH | 7.5 | 3.2 | 5.2 | 8.8 |
| ��ȫ������pH | 9.7 | 3.7 | 6.4 | 10.4 |
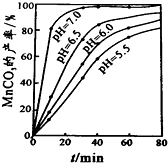
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��5 mL 0.02 mol/L��H2SO4��Һ��5 mL 0.02 mol/L NaOH��Һ��ֻ�ϣ�����Ϻ���Һ�����Ϊ10 mL������Һ��pH=2 | |
| B�� | ij���ʵ���Һ����ˮ�����c��H+��=1��10-a mol/L����a��7����pHһ��Ϊ14-a | |
| C�� | pH��ȵĢ�CH3COONa ��C6H5ONa ��NaHCO3��Һ��c��Na+����С��ϵ���٣��ۣ��� | |
| D�� | CH3COONa��Һ�м�������KNO3�����ļ�����Һһ���У�c��Na+��+c��H+��=c��CH3COO-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
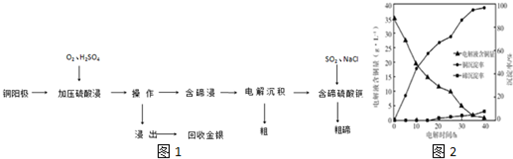
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ư�۳��ڷ��ûᱻ�����е��������������� | |
| B�� | ����־��н�ǿ����ʴ�ԣ�����Ҳ�н�ǿ����ʴ�� | |
| C�� | ����β���е�������IJ�����Ҫ�����������к��е�Ԫ�ض������� | |
| D�� | ��ʯ�ͽ��з�����Եõ����౽��ͬϵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
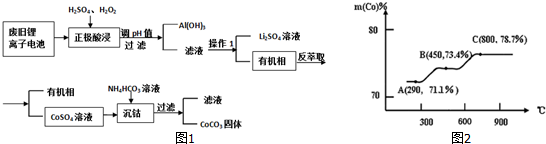
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮԭ��Ϊ��Al3++3H2O=Al��OH��3��+3H+ | |
| B�� | ����Һ��AlO2-��F-��K+��Na+�ܴ������� | |
| C�� | �������NH3•H2O��Ӧ�����ӷ���ʽΪ��Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D�� | �������Ba��OH��2��Һ��Ӧ�����ӷ���ʽΪ��Al3++2SO42-+4OH-+2Ba2+=AlO2-ʮ2BaSO4��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
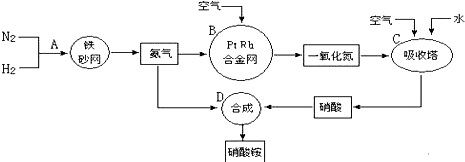
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com