
| A. | c(OH-)=c(Na+)+c(H+) | |
| B. | 该溶液中的c(OH-)=1.0x10-3mol•L-1 | |
| C. | 加水稀释104倍所得溶液显碱性 | |
| D. | 与pH=3的HF溶液等体积混合所得溶液:c(Na+)=c (F-)+c(HF) |
分析 A.根据溶液中的电荷守恒进行判断;
B.氢氧化钠溶液中氢离子的浓度为水电离产生,根据水的离子积计算;
C.碱溶液加水稀释后不会变成中性或酸性溶液,仍然为碱性溶液;
D.氟化氢为弱电解质,混合液中HF过量,则c(Na+)<c (F-)+c(HF).
解答 解:A.根据电荷守恒,溶液中阳离子所带电荷等于阴离子所带电荷,即:c(OH-)=c(Na+)+c(H+),故A正确;
B.氢氧化钠溶液中氢离子的浓度为水电离产生,pH=11的NaOH溶液中c(H+)=1.0×10-11mol•L-1,根据水的离子积常数,溶液中氢氧根离子的浓度为:c(OH-)=1.0×10-3mol•L-1,故B正确;
C.该氢氧化钠溶液中c(OH-)=1.0×10-3mol•L-1,加水稀释104倍所得溶液中,氢氧根离子只能接近1.0×10-7mol•L-1,溶液仍然为碱性溶液,故C正确;
D.pH=3的HF溶液中,HF的浓度大于0.001mol/L,两溶液等体积混合后,HF过量,则:c(Na+)<c (F-)+c(HF),故D错误;
故选D.
点评 本题考查溶液中离子浓度的比较、酸碱混合的定性判断、弱电解质的电离平衡及其影响等知识,题目难度中等,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
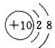 .
.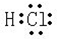 ,
,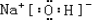 ,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).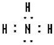 ,其水溶液的pH>7(填“<”或“>”).
,其水溶液的pH>7(填“<”或“>”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
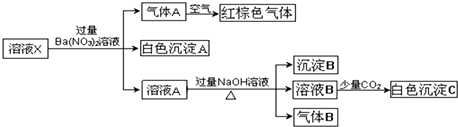
| A. | 原溶液中可能含有NO3-和Al3+ | |
| B. | 白色沉淀C可能是Al(OH)3 | |
| C. | 原溶液中一定存在NH4+、Fe2+、SO42-、Cl- | |
| D. | 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| B. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ | |
| C. | 0.2mol/L的NaHCO3溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+) | |
| D. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 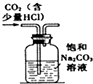 图装置:除去二氧化碳中的少量氯化氢气体 | |
| B. | 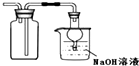 图装置:收集二氧化硫并吸收尾气 | |
| C. |  图装置:用酸性高锰酸钾溶液滴定过氧化氢溶液 | |
| D. |  图装置:用水吸收氯化氢气体并防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
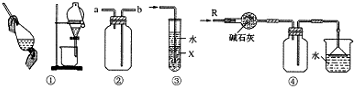
| A. | 装置①可用于分离苯和水的化合物 | |
| B. | 装置②可用于排气法收集H2、CO2、Cl2、NO、NO2等气体 | |
| C. | 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| D. | 装置④可用于干燥、收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘有智力元素之称,所以应该大量服用补碘药片 | |
| B. | 汽车尾气中的氮氧化物是汽油不完全燃烧产生的 | |
| C. | 二氧化硫可用于食品防腐,但不能用于食品漂白 | |
| D. | “辽宁舰”上使用的特种钢缆属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
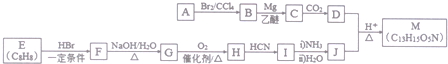
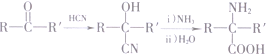 (R′表示氢原子或烃基)
(R′表示氢原子或烃基)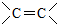 ,
, .
.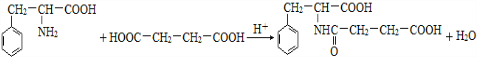 .
.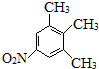 、
、 (不考虑立体异构).
(不考虑立体异构).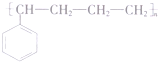 的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO$→_{催化剂/△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}/△}^{CH_{3}OH}$CH3COOCH3.
的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO$→_{催化剂/△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}/△}^{CH_{3}OH}$CH3COOCH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
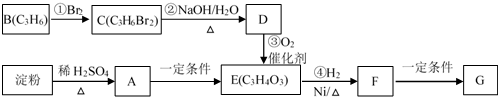
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com