
���� ��1����ɢ������ֱ������1-100nm֮���Ϊ���壻
��2����ˮ��Һ�к�����״̬�¾����ܵ���Ļ�����Ϊ�ǵ���ʣ�
��3���������ƶ������ӻ���ӵĵ�����ܵ��磻
��4�������ֻ��������ʹ��ɵ��ǻ���
��5��Al�����ᷴӦ������������������
��6��C��Ũ���ᷴӦ���ɶ�����̼�����������ˮ��
��� �⣺��1����ɢ������ֱ������1-100nm֮���Ϊ���壬�����Ľ���Ϊ������Һ����������Һ��ѪҺ���ȣ��ʢٵ�����Һ�ǽ��壬�ʴ�Ϊ���٣�
��2����ˮ��Һ�к�����״̬�¾����ܵ���Ļ�����Ϊ�ǵ���ʣ������ķǵ�������Ҵ������ǡ��ǽ���������Ͱ����ȣ��ʢڢ�Ϊ�ǵ���ʣ��ʴ�Ϊ���ڢ
��3���������ƶ������ӻ���ӵĵ�����ܵ��磬�ʢ��ۻ���KNO3���ܵ���ĵ���ʣ��ʴ�Ϊ���ۣ�
��4�������ֻ��������ʹ��ɵ��ǻ����ʣ��ٵ�����Һ�͢�BaCl2��Һ�ǻ����ʴ�Ϊ���٢ࣻ
��5��Al�����ᷴӦ��������������������������������������Բ𣬹����ӷ���ʽΪ��2Al+6H+=2Al3++3H2�����ʴ�Ϊ��2Al+6H+=2Al3++3H2����
��6��C��Ũ���ᷴӦ���ɶ�����̼�����������ˮ����ѧ����ʽΪC+2H2SO4��Ũ��=CO2��+2SO2��+2H2O�����ڷ�Ӧ������ɾ����ܲ𣬹ʻ�ѧ����ʽ��Ϊ���ӷ���ʽ���ʴ�Ϊ��C+2H2SO4��Ũ��=CO2��+2SO2��+2H2O��
���� ���⿼���˵���ʡ��ǵ���ʡ������֪ʶ�㣬�ѶȲ�����ȷ�������ǵ���ʵ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������̼�IJ�����������Դ�����һ����Ҫս�Է���
������̼�IJ�����������Դ�����һ����Ҫս�Է���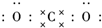 ��������ѧ���������ǹ��ۼ���
��������ѧ���������ǹ��ۼ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
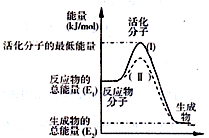 ��֪��Ӧ��3I-��aq��+S2O82-��aq���TI3-��aq��+2SO42-��aq��+Q
��֪��Ӧ��3I-��aq��+S2O82-��aq���TI3-��aq��+2SO42-��aq��+Q| ʵ���� | �� | �� | �� | �� | �� |
| c��I-��/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c��S2O82-��/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol�����к���1.204��1024����ԭ�ӣ��ڱ�״����ռ�����22.4 L | |
| B�� | 1 mol������1.5 mol����������ͬ����ԭ���� | |
| C�� | ��He��H2��O2����������¶Ⱥ��ܶȶ���ͬʱ�����ǵ�ѹǿ��С��p��O2����p��He����p��H2�� | |
| D�� | �����ʵ����ĸɱ��������ǣ�����ʽΪC6H12O6��������̼ԭ����֮��Ϊ1��6����ԭ����֮��Ϊ1��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
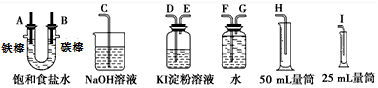
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������еμӰ�ˮ��H++OH-�TH2O | |
| B�� | Fe��OH��3��������Fe��OH��3+3H+�TFe3++3H2O | |
| C�� | ͭ����ϡ���3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O | |
| D�� | Na2O2��H2O��Ӧ�Ʊ�O2��Na2O2+H2O�T2Na++2OH-+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������һ����CH2ԭ���ŵ��л�����ͬϵ�� | |
| B�� | �����Ԫ������������ͬ������ͬһ���� | |
| C�� | ����ʽ��ͬ���ṹʽ��ͬ���л���һ����ͬ���칹�� | |
| D�� | ������ͬͨʽ�����һ�������ɸ�CH2ԭ���ŵ��л���һ����ͬϵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ķ�Һ����ˮ�ۣ���ˮ������ˮ�� | |
| B�� | ��ҽ�þƾ�������������ɵõ����ߴ��ȵľƾ���Һ | |
| C�� | ���ȸ�����ع�����ȡ���ռ�����������Ӧ����ֹͣ���� | |
| D�� | ����ʵ��ʱ����ˮӦ���Ͽڽ��¿ڳ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com