
把一块镁铝合金投入到1mol/L 盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示。下列说法中不正确的是( )
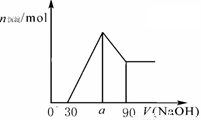
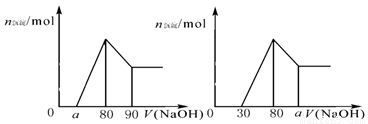
图A 图B 图C
A.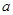 的取值范围为0≤ a<50
的取值范围为0≤ a<50
B. 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则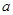 的取值范围为80<a<90
的取值范围为80<a<90
D.若将关系图改为C图时,则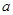 的取值范围为75<a<90
的取值范围为75<a<90
C
【解析】
试题分析:A、假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50,正确;B、n(Al)=n(Al(OH)3)=0.01mol,所以沉淀Al3+需要的OH-为0.03mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为80-a,若假设盐酸不剩,所以沉淀Mg2+需要NaOH溶液的体积最大值为50mL,求出n (Mg)的最大值为0.025mol,所以该合金中镁铝两元素物质的量之比的最大值为2.5,正确;C、采用极值法计算,当没有铝离子时,生成的沉淀不和氢氧化钠反应导致a值最小,80=a;当生成的沉淀全部是氢氧化铝时,氢氧化铝能和氢氧化钠反应生成偏铝酸钠,导致a值最大,生成氢氧化铝沉淀所用的氢氧化钠体积是溶解氢氧化铝所用氢氧化钠体积的3倍,所以溶解氢氧化铝所用氢氧化钠的体积为50/3,a=96.7,实际上存在镁离子,所以a的取值范围是80<a<96.7,错误;D、当没有铝离子时,生成的沉淀全部是氢氧化镁,氢氧化镁和氢氧化钠不反应,此时a值最大为90;当生成的沉淀全部是氢氧化铝,生成的氢氧化铝又能和氢氧化钠完全转化为偏铝酸钠时a值最小,生成氢氧化铝所用的氢氧化钠与溶解氢氧化铝所用的氢氧化钠的体积之比=3:1,所以a=(90-30)÷4×3+30=75,实际上溶液中含有铝离子和镁离子,所以a的取值范围是75<a<90,正确。
考点:本题考查图像的分析及计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?抚顺二模)把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
(2011?抚顺二模)把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
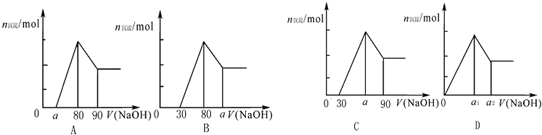
| A、a的取值范围为0≤a<50 | ||
B、
| ||
| C、若将关系图改为B图时,则a的取值范围为80<a<90 | ||
| D、若将关系图改为C图时,则a的取值范围为75<a<90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
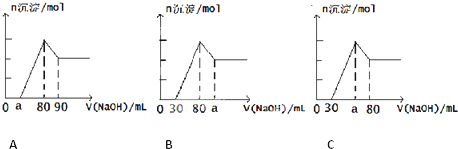
| A、A图中a的取值范围为0≤a<50 | ||
B、A图中
| ||
| C、若将关系图改为B图时,则a的取值范围为80<a<90 | ||
| D、若将关系图改为C图时,则a的取值范围为67.5<a<80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com