
【题目】20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药爆炸的化学方程式为:S + 2KNO3 +3C = K2S +N2↑ +3CO2↑。20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有肼(N2 H4)、液氢等。
(1)K原子核外电子云有___种不同的伸展方向,电子填充了__个轨道;写出硫原子的核外电子排布式__,比较反应所涉及的原子的原子半径大小:__;
(2)写出产物中含极性键的非极性分子的结构式__,产物K2S的电子式为___;
(3)已知S和氯水反应会生成两种强酸,其离子方程式为_______;
(4)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富。有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。写出其爆炸的化学方程式____。
【答案】4 10 1s22s22p63s23p4 K>S>C>N>O O=C=O ![]() S+3Cl2+4H2O=SO42-+8H++6Cl- 2HN3=H2+3N2
S+3Cl2+4H2O=SO42-+8H++6Cl- 2HN3=H2+3N2
【解析】
(1)K原子的电子排布式为1s22s22p63s23p64s1,s有1种伸展方向,p有3种伸展方向,电子填充了10个轨道,硫原子的核外电子排布式为,1s22s22p63s23p4;电子层数越多,半径越大,相同电子层结构,原子序数越小半径越大;
(2)K2S是离子化合物,硫离子和钾离子形成离子键,据此写出电子式;CO2是含极性键的非极性分子,CO2是直线形分子,碳原子与2个氧原子都形成双键,据此写出结构式;
(3)S和氯水反应会生成两种强酸,可知酸为盐酸和硫酸,然后配平;
(4)先根据质量守恒确定氢气的质量,然后求出氮原子、氢原子的物质的量,确定化合物的分子式,最后书写化学方程式。
(1)K原子的电子排布式为1s22s22p63s23p64s1,原子核外电子云有4种不同的伸展方向,电子填充了10个轨道;硫原子的核外电子排布式为:1s22s22p63s23p4;电子层数越多,半径越大,相同电子层结构,原子序数越小半径越大,故原子半径K>S>C>N>O;
(2)CO2是含极性键的非极性分子,CO2是直线形分子,碳原子与2个氧原子都形成双键,结构式为O=C=O,硫化钾是离子化合物,硫离子和钾离子形成离子键,硫化钾的电子式为![]() ;
;
(3)S和氯水反应会生成盐酸和硫酸,反应的离子方程式为:S+3Cl2+4H2O=SO42-+8H++6Cl-;
(4)86g该化合物爆炸分解会生成标况下N2 67.2L和另一种气体单质H2,N2的物质的量为![]() =3mol,质量为3mol×28g/mol=84g,则氢气的质量为86g-84g=2g,H2物质的量为1mol,氮原子、氢原子的物质的量分别为6mol、2mol,两者的物质的量之比为3:1,含氮化合物的分子式为HN3,化学方程式为:2HN3=H2+3N2。
=3mol,质量为3mol×28g/mol=84g,则氢气的质量为86g-84g=2g,H2物质的量为1mol,氮原子、氢原子的物质的量分别为6mol、2mol,两者的物质的量之比为3:1,含氮化合物的分子式为HN3,化学方程式为:2HN3=H2+3N2。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/kJ | ||
SO2 | O2 | SO3 | ||
甲 | 2 | 1 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中正确的是
A.两容器中反应的平衡常数不相等
B.达到平衡时SO2的体积分数:甲<乙
C.197>Q1>Q2
D.生成1molSO3(l)时放出的热量等于98.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α﹣苯基丙烯酸可用于合成人造龙涎香,现以甲苯为原料,按下列方法合成(从F开始有两条合成路线)
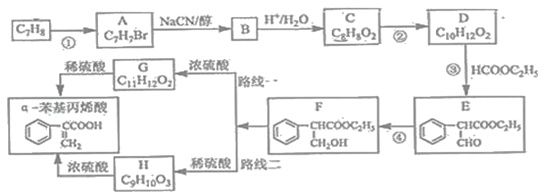
已知:①CH3CH2Br+NaCN![]() CH3CH2CN+NaBr
CH3CH2CN+NaBr
②CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
完成下列填空:
(1)写出D的结构简式______。
(2)写出反应类型:反应④______。
(3)写出反应所需要试剂与条件:反应①______,反应②______。
(4)写出一种满足下列条件的D的同分异构体的结构简式______。
①能发生银镜反应
②能与FeCl3溶液发生显色反应
③分子中有5种不同化学环境的氢原子
(5)检验E是否完全转化为F的方法是______。
(6)路线二与路线一相比不太理想,理由是______。
(7)利用已知条件,设计一条由![]() 制备
制备![]() 的合成路线_________________。(合成路线的表示方法为:A
的合成路线_________________。(合成路线的表示方法为:A![]() B…
B…![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示:

下列说法正确的是
A. 离子半径的大小顺序:e>f>g>h
B. 与x形成简单化合物的沸点:y>z>d
C. x、z、d三种元素形成的化合物可能含有离子键
D. e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l)+Q (Q>0);完成下列问题:
2CO2(g)+S(l)+Q (Q>0);完成下列问题:
(1)该反应的平衡常数表达式是___;2L容器中,10分钟内,气体密度减小了8g/L,则CO的反应速率是___。
(2)如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加SO2的浓度 c.升温 d.及时移走产物
(3)若反应在恒容的密闭容器中进行,下列有关说法正确的是___。(选填编号)
A.平衡前,随着反应的进行,容器内压强始终不变
B.当容器内温度不再变化时,反应达到了平衡
C.平衡时,其他条件不变,升高温度可增大平衡常数
D.其他条件不变,使用不同催化剂,该反应热效应不同
硫酸工业尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
(4)该溶液中c(Na+)与c(OH-)之比为___。
该溶液中c(OH-)=c(H+)+ + ___(用溶液中所含微粒的浓度表示)。
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量由多到少的顺序是___(用编号排序)
A.Na2SO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下:
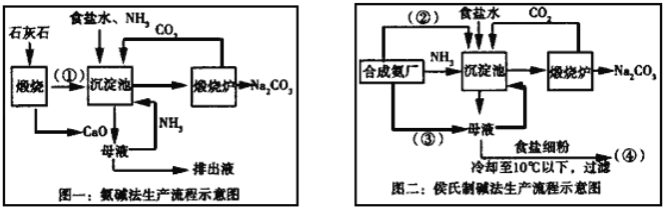
完成下列填空:
(1)写出化学式:②_____、③____
(2)从理论上分析,氨碱法生产过程中_____(选填“需要”、“不需要”)补充氨气,写出该工艺中生成CaCl2的化学方程式________________。
(3)对联碱法中从母液中提取氯化铵晶体的过程进行分析,所得结论合理的是______。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气可把碳酸氢钠转化为碳酸钠,防止碳酸氢钠析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(4)取“侯氏制碱法”生产的纯碱样品5.500g,配成500mL溶液,取25mL溶液用0.1000mol/L的标准盐酸滴定(设其中的杂质不与盐酸反应),用酚酞作指示剂,三次滴定消耗盐酸的平均量为25.00mL.计算样品中纯碱的质量分数______。(已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3)某活动小组根据上述制碱原理,用如下所示装置(夹持装置省略)制备碳酸氢钠.
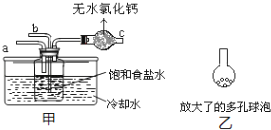
(5)实验时,须先从____管通入_____气体,再从_____管中通入_____气体。
(6)有同学建议在甲装置的b管下端连接乙装置,目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
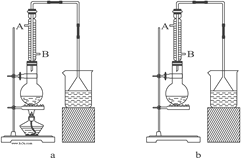
(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲学生用如1图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下:
(1)检查装置的气密性,然后向烧瓶中加入一定量的苯和液溴。
(2)向锥形瓶中加入适量某液体,小试管中加入CCl4,并将右边的长导管口浸入CCl4液面下。
(3)将A装置中的纯铁丝小心向下插入混合液中。

请填写下列空白:
①根据课本所学知识:苯是平面型分子(所有原子共平面),甲烷是正四面体型分子,由此推测![]() 中最多______个原子共平面。
中最多______个原子共平面。
②装置B的锥形瓶中小试管内CCl4的作用是_______;小试管外的液体是________。
③反应后,向锥形瓶B中滴加______,现象是___________________。
④乙同学使用图2装置,a中加入一定量的苯,液溴,铁屑,d中液体仍与图1B中小试管外液体相同,后续操作仍然为③,用此装置证明溴和苯的反应是取代反应而不是加成反应,甲认为乙同学的实验不严密,试说明不严密的理由______________。
⑤写出苯与液溴反应的化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向含有![]() 、
、![]() 的200 mL溶液中加入NaOH固体时,溶液中
的200 mL溶液中加入NaOH固体时,溶液中![]() 、
、![]() 随pH的变化曲线如图所示(忽略加人固体时溶液体积的变化)。下列叙述不正确的是( )
随pH的变化曲线如图所示(忽略加人固体时溶液体积的变化)。下列叙述不正确的是( )
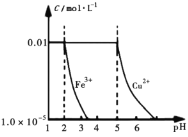
A.![]()
B.![]() 时溶液中的阳离子主要为
时溶液中的阳离子主要为![]() 和
和![]()
C.向含有![]() 杂质的
杂质的![]() 溶液中加入CuO或
溶液中加入CuO或![]() 可除去溶液中混有的
可除去溶液中混有的![]()
D.当加入0.03 mol NaOH时,![]() 、
、![]() 完全沉淀
完全沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com