
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
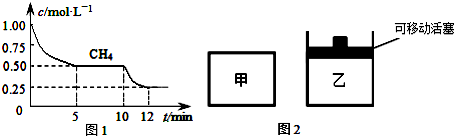
分析 (1)①10min时瞬间甲烷浓度不变,平衡正向移动,正反应为吸热反应,可能是升高温度,或移走生成物等;
②正反应为气体物质的量增大的反应,乙为恒温恒压,甲为恒温恒容,平衡时甲中压强大于乙中压强,乙中平衡等效再在甲中平衡基础上降低移动,平衡正向移动;
(2)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v(正)、v(逆)相对大小;
(3)正反应为气体体积减小的放热反应,增大压强或降低温度或分离液氨均使平衡正向移动,可以提高合成氨原料转化率;
(4)①在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,转化的氮气为1mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 4 0
变化量(mol):1 3 2
平衡量(mol):1 1 2
容器体积变为10L,再根据K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
②相同条件下达到平衡时,混合物中各组分的物质的量与①中平衡相同,说明两平衡为完全等效平衡,①中转化率比②中的高,①中参加反应的氮气的物质的量较②中的多;
③可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.
解答 解:(1)①10min时瞬间甲烷浓度不变,平衡正向移动,正反应为吸热反应,可能是升高温度,或移走生成物等,
故答案为:升高温度等;
②正反应为气体物质的量增大的反应,乙为恒温恒压,甲为恒温恒容,平衡时甲中压强大于乙中压强,乙中平衡等效再在甲中平衡基础上降低移动,平衡正向移动,故转化率:α甲(CH4)<α乙(CH4),
故答案为:<;
(2)反应气体气体体积相等,可以用物质的量代替浓度计算浓度商,则此时浓度商Qc=$\frac{2×2}{0.5×8.5}$=$\frac{2×2}{0.5×0.85}$=0.94<K=1,反应向正反应进行,则v(正)>v(逆),
故选:a;
(3)正反应为气体体积减小的放热反应,增大压强或降低温度或分离液氨均使平衡正向移动,可以提高合成氨原料转化率,
故答案为:增大压强或降低温度或分离液氨;
(4)①在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,转化的氮气为1mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 4 0
变化量(mol):1 3 2
平衡量(mol):1 1 2
容器体积变为10L,则平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.{2}^{2}}{0.1×0.{1}^{3}}$=400,
故答案为:400;
②.①中参加反应的氮气为1mol,放出热量为92.4kJ,相同条件下达到平衡时,混合物中各组分的物质的量与①中平衡相同,说明两平衡为完全等效平衡,①中转化率比②中的高,①中参加反应的氮气的物质的量较②中的多,故②中放出的热量<92.4kJ,
故答案为:<;
③a.v(N2)=3v(NH3),未指明正逆速率,若为2v正(N2)=v逆(NH3)时反应到达平衡,故a错误;
b.混合气体总质量不变,容器容积不变,混合气体的密度为定值,故b错误;
c.混合气体总质量不变,随反应进行混合气体物质的量减小,平衡相对分子质量增大,当混合气体的平均相对分子质量不随时间改变,说明反应到达平衡,故c正确;
d.随反应进行混合气体总物质的量减小,恒温恒容下压强减小,容器中的压强不随时间改变,说明反应到达平衡,故d正确;
e.平衡时N2、NH3的浓度关系与二氧化氮转化率有关,平衡时不一定相等,故e错误,
故选:cd.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、平衡常数、平衡状态判断等,(3)中②注意对等效平衡规律的理解掌握,难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、I-、CO32-、Fe3+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Mg2+、Cl-、Ca2+ | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
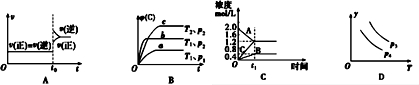
| A. | 对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 对于反应 2A(g)+B(g)?C(g)+D(g)△H<0,p2>p1,T1>T2 | |
| C. | 该图象表示的化学方程式为:2A═B+3C | |
| D. | 对于反应 2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| B | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的结晶 |
| C | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验:
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol•L-1 NaOH溶液中Na+数为0.5NA | |
| B. | 标准状况下,22.4 L四氯化碳含有的分子数为NA | |
| C. | 常温常压下,1mol Na2O2与足量CO2反应,电子转移数为NA | |
| D. | 标准状况下,16 g氧气臭氧的混合气体所含原子数一定为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com