
| A. | 当容器内密度保持不变时,可以判断反应已达平衡 | |
| B. | 其他条件不变,将容器体积变为5L,C的平衡浓度变为原来的2倍 | |
| C. | 其他条件不变.若增大压强,则物质A的转化率减小 | |
| D. | 达到平衡时,C的体积百分含量为35.3% |
分析 达到平衡时生成0.6molC,则
2A(g)+B(g)?2C(g)
开始 1 1 0
转化 0.6 0.3 0.6
平衡 0.4 0.7 0.6
A.均为气体,混合气体的质量不变,且密闭容器的体积不变;
B.将容器体积变为5L,若平衡不移动,C的浓度为原来的2倍,但体积减小,压强增大,平衡正向移动;
C.增大压强,平衡正向移动;
D.达到平衡时,C的体积百分含量为$\frac{0.6}{0.4+0.7+0.6}$×100%.
解答 解:达到平衡时生成0.6molC,则
2A(g)+B(g)?2C(g)
开始 1 1 0
转化 0.6 0.3 0.6
平衡 0.4 0.7 0.6
A.均为气体,混合气体的质量不变,且密闭容器的体积不变,则密度始终不变,不能判定平衡状态,故A错误;
B.将容器体积变为5L,若平衡不移动,C的浓度为原来的2倍,但体积减小,压强增大,平衡正向移动,则C的平衡浓度大于原来的2倍,故B错误;
C.增大压强,平衡正向移动,A的转化率增大,故C错误;
D.达到平衡时,C的体积百分含量为$\frac{0.6}{0.4+0.7+0.6}$×100%=35.3%,故D正确;
故选D.
点评 本题考查化学平衡,为高频考点,把握化学平衡三段法、平衡移动、体积分数计算为解答的关键,侧重分析与计算能力的考查,注意选项B为易错点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
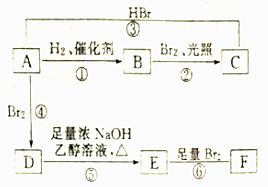
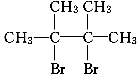
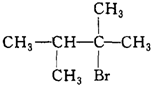 .
. ;写出由E→F的化学方程式
;写出由E→F的化学方程式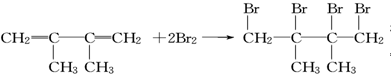 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH3COONa 溶液中滴入无色酚酞,溶液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| C. | 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3=Na++H++SO32- | |
| D. | 在草酸溶液中滴入几滴稀H2SO4酸化的KMnO4溶液,溶液无色:2MnO4-+5H2C2O4+6H +=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于10-9m~10-7m之间的微粒称为胶体 | |
| B. | 明矾溶于水可产生具有吸附性的胶体粒子,常用于饮用水的杀菌消毒 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,发现均不能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag得到电子 | B. | X为AgS | ||
| C. | O2被还原 | D. | 每生成1 mo1X转移电子数4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
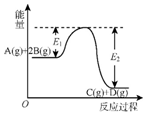
| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,升高温度,正反应速率增大,逆反应速率减小 | |
| D. | 若减小体积,平衡会移动,当反应再次达到平衡时,A的平衡浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
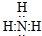 ,氯化铵
,氯化铵 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
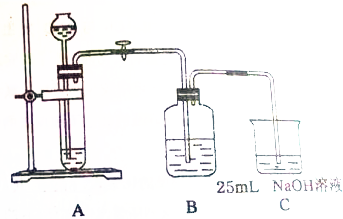 某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:
某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | CH4 (g)+2 O2(g)═CO2(g)+2 H2O (l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2 O2(g)═CO2(g)+2 H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | CH4(g)+2 O2 (g)═CO2(g)+2 H2O (l)△H=+890.3 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com