
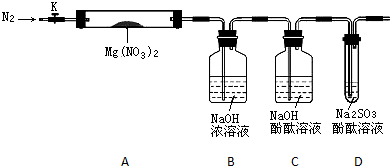
 NaHSO3+NaOH、2Na2SO3+O2═2Na2SO4;乙;
NaHSO3+NaOH、2Na2SO3+O2═2Na2SO4;乙;

 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| A、棉花、木材和植物秸秆的主要成分都是纤维素 |
| B、含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 |
| C、PM 2.5亦称可入肺颗粒物,分散在空气中形成胶体,表面积大,能吸附有毒有害物质 |
| D、水结冰是从上向下,而油脂凝固是从下向上进行,这一现象合理的解释是因为油脂密度大于水的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3+H2O=H2SO4 | ||||
| B、Cl2+H2O=HCl+HClO | ||||
| C、2F2+2H2O=4HF+O2 | ||||
D、C+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
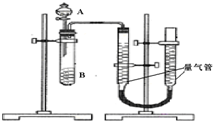 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |

| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO4=2Na++SO4-2 |
| B、Ba(OH)2=Ba2++(OH-)2 |
| C、KClO3=K++Cl-+3O2- |
| D、Fe2(SO4)3=2Fe3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用 | 无明显现象 |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 | 有白色沉淀 |
| 步骤3:取少量步骤2得到的滤渣加入过量盐酸 | 滤渣不能完全溶解,说明酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液, | |
| 步骤5:往B试管中加入 振荡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com