
| A. | 加入一小块铜片 | B. | 改用等体积 98%的硫酸 | ||
| C. | 用等量铁粉代替铁片 | D. | 改用等体积3mol/L盐酸 |
分析 1mol/L盐酸与铁片的反应,增大盐酸浓度、将铁片换为铁粉、升高温度、使其形成原电池且Fe作负极都能加快反应速率,据此分析解答.
解答 解:A.Fe、Cu和稀盐酸能构成原电池,Fe易失电子作负极而加快反应速率,故A不选;
B.将稀盐酸改用浓硫酸,浓硫酸和Fe发生钝化现象且二者反应生成二氧化硫而不是氢气,故B选;
C.将铁粉代替铁片,增大反应物接触面积,反应速率加快,故C不选;
D.改用等体积3mol/L稀盐酸,盐酸浓度增大,反应速率加快,故D不选;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、温度、催化剂、反应物接触面积等因素对反应速率影响原理是解本题关键,易错选项是B.


科目:高中化学 来源: 题型:解答题
 氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠或过氧化钙跟足量水反应都生成0.5mol氧气 | |
| C. | 过氧化钙中阴阳离子数之比为2:1 | |
| D. | 过氧化钙中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | KCl | C. | CaCl2 | D. | LiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氮元素只被氧化 | |
| B. | 豆科植物根瘤菌固氮属于自然固氮 | |
| C. | 其它元素也参与了氮循环 | |
| D. | 含氮无机物和含氮有机物可相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下甲能与氢气直接化合,乙不能 | |
| B. | 甲的氧化物对应的水化物酸性比乙强 | |
| C. | 甲得到电子能力比乙强 | |
| D. | 甲、乙形成的化合物中,甲显负价,乙显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
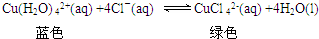
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com