
WO3可用于制备电阻元件、电子射线屏等。其工业生产流程如下:
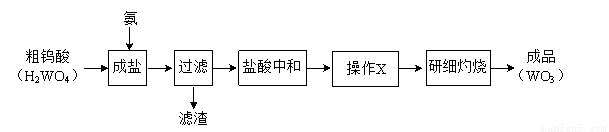
(1)操作X的目的是为了获得纯净的仲钨酸铵晶体,该操作包括:将用盐酸中和后的溶液??? 、冷却结晶、????? 、低温烘干。
(2)实际工业生产中,粗仲钨酸铵晶体(含少量NH4Cl晶体)可不经提纯就直接灼烧,其原因是????? 。
(3)已知:仲钨酸铵晶体[x(NH4)2O·yWO3·zH2O]受热分解的化学方程式如下:
x(NH4)2O·yWO3·zH2O→WO3 +NH3↑+H2O↑(未配平)。
某同学为测定仲钨酸铵晶体的组成,进行如下实验:
①准确称取16.21g样品,研细灼烧;
②将产生的气体通入装有碱石灰干燥管,充分吸收称得干燥管增重1.44g;
③称量冷却后的固体质量为13.92g。
通过计算确定此仲钨酸铵晶体的化学式(写出计算过程)。
(1)加热浓缩 过滤、洗涤
(2)杂质NH4Cl被灼烧分解后全部转化为气体
(3)m(NH3)=16.21g-13.92g-1.44g=0.85g
n(NH4+)=n(NH3)= 0.85g ÷17g·mol—1=0.05mol?
样品中结晶水:n(H2O)=1.44 g ÷18 g·mol—1-0.05mol÷2=0.055 mol
n(WO3)=13.92g÷232 g·mol—1=0.06mol
x:y:z=0.025 mol:0.06mol:0.055 mol=5:12:11
故仲钨酸铵晶体的化学式为5(NH4)2O·12WO3·11H2O。
【解析】
试题分析:(1)将溶液蒸发浓缩后才能冷却结晶,晶体与溶液分开采用过滤的方法,并要洗涤除去晶体表面杂质;(2)NH4Cl受热分解为HCl和NH3,从固体中分离;
(3)物质组成的计算
根据②步干燥管增重为水的量
样品中结晶水:n(H2O)=1.44 g ÷18 g·mol—1-0.05mol÷2=0.055 mol
根据质量守恒计算产生氨气的量,计算NH4+的量
m(NH3)=16.21g-13.92g-1.44g=0.85g
n(NH4+)=n(NH3)= 0.85g ÷17g·mol—1=0.05mol
根据③步得到固体为WO3,n(WO3)=13.92g÷232 g·mol—1=0.06mol
所以有x:y:z=0.025 mol:0.06mol:0.055 mol=5:12:11
故仲钨酸铵晶体的化学式为5(NH4)2O·12WO3·11H2O。
考点:考查工业流程原理及物质组成计算有关问题。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com