
下列实验操作中:①取液体试剂 ②取固体试剂 ③溶解
④过滤 ⑤蒸发,一定要用到玻璃棒的是( )
A.①②③ B.②③④
C.①②⑤ D.③④⑤
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20→NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
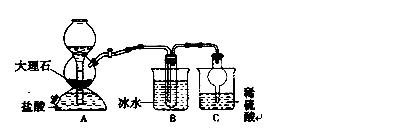
34.A装置中所发生反应的离子方程式为 C装置的作用为
35. 下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);
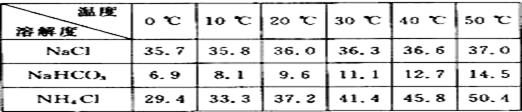
参照表中数据,请分析B装置中使用冰水的目的是 36.该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用 。 37.若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10-8 mol·L-1 |
| H2CO3 | K1=4.3×10-7 mol·L-1 |
| K2=5.6×10-11 mol·L-1 |
A.[HCO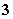 ]>[ClO-]>[OH-]
]>[ClO-]>[OH-]
B.[ClO-]>[HCO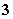 ]>[H+]
]>[H+]
C.[HClO]+[ClO-]=[HCO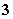 ]+[H2CO3]
]+[H2CO3]
D.[Na+]+[H+]=[HCO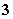 ]+[ClO-]+[OH-]
]+[ClO-]+[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol Na和1 mol Al的混合物投入足量水中,产生气体在标准状况下的体积为( )
A.11.2 L B.22.4 L
C.33.6 L D.44.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定量的密闭容器中进行反应:N2(g)+3H22NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是( )
A.N2为0.2 mol/L,H2为0.6 mol/L
B.N2为0.15 mol/L
C.N2、H2均为0.18 mol/L
D.NH3为0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2(g)+O2(g)2SO3(g) ΔH<0的实验数据如下表:
| 温度 | 不同压强下SO2的转化率(%) | ||||
| 1×105Pa | 5×105Pa | 1×106Pa | 5×106Pa | 1×107Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)应选择的温度是________。
(2)应采用的压强是________,理由是
________________________________________________________________________________________________________________________________________________。
(3)在合成SO3的过程中,不需要分离出SO3的原因是________________________________________________________________________________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
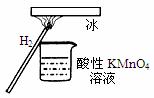
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电 场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32 -)>c(HCO3- )>c(OH-)
B.20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(CH3COO-)>c(Cl-) >c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-)
D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com