
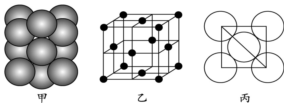
| A. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| B. | 乙醇分子的比例模型: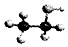 | |
| C. | CF2Cl2有两种同分异构体 | |
| D. | HOCH2COOH缩聚物的结构简式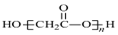 |
分析 A、3-甲基-1-丁烯的主链上有4个碳原子,在1号和2号碳原子间有碳碳双键,在3号碳原子上有一个甲基;
B、比例模型表示原子的比例大小关系、原子之间的连接顺序与空间结构,不能表示原子之间的成键情况;
C、甲烷是正四面体型结构,结构中的四个H原子完全等价;
D、HOCH2COOH发生自身的缩聚反应,酸脱羟基醇脱氢.
解答 解:A、3-甲基-1-丁烯的主链上有4个碳原子,在1号和2号碳原子间有碳碳双键,在3号碳原子上有一个甲基,故结构简式为(CH3)2CHCH=CH2,故A正确;
B、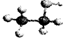 表明乙醇分子中成键情况,是乙醇的球棍模型,乙醇的比例模型为
表明乙醇分子中成键情况,是乙醇的球棍模型,乙醇的比例模型为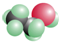 ,故B错误;
,故B错误;
C、甲烷是空气正四面体结构,碳原子位于正四面体的中心,4个氢原子位于4个顶点上,4个氢原子完全等效,CF2Cl2是甲烷的取代产物,所以CF2Cl2也是空间四面体结构,只有一种结构,故C错误;
D、HOCH2COOH发生自身的缩聚反应,酸脱羟基醇脱氢,故所得的缩聚反应的产物为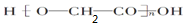 ,故D错误.
,故D错误.
故选A.
点评 本题考查了有机物的球棍模型和比例模型的区别以及根据单体来推导缩聚产物,难度不大,应注意的是CF2Cl2的空间结构.


科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、NO3-、SO42- | B. | K+、Na+、Cl-、ClO- | ||
| C. | Zn2+、NH4+、NO3-、Cl- | D. | K+、Na+、Ca2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 +3Br2→
+3Br2→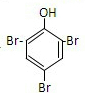 +3HBr
+3HBr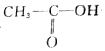 +H-O-CH2CH3$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O
+H-O-CH2CH3$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O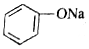 +CO2+H2O→C6H5OH+NaHCO3.
+CO2+H2O→C6H5OH+NaHCO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氯气中安静燃烧,发出苍白色火焰,瓶口出现的“雾气”是盐酸小液滴 | |
| B. | 漂白粉溶液中滴入少量盐酸,可增强其漂白效果 | |
| C. | 钠在空气中燃烧,产生黄色火焰,生成白色的Na2O的固体 | |
| D. | 铁丝在氯气中燃烧,生产棕红色的烟,氯化铁的水溶液呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
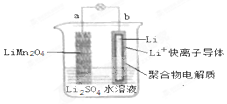 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )| A. | a 为电池的正极 | |
| B. | 电池充电反应为 LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a 极锂的化合价发生变化 | |
| D. | 放电时,溶液中 Li+从 b 向 a 迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠加入到紫色石蕊试液中,紫色石蕊先变红后褪色且有气泡产生 | |
| B. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| C. | 硅、氯、硫、氮、钠元素在自然界只有化合态没有游离态 | |
| D. | 浓硝酸有氧化性,稀硝酸没有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
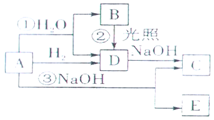 A是黄绿色气体单质,如图所示,
A是黄绿色气体单质,如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,能使品红溶液褪色 | |
| B. | SO2具有漂白性,能使溴水褪色 | |
| C. | SO2具有还原性,能与Ba(NO3)2溶液反应生成沉淀 | |
| D. | SO2具有漂白性,能使滴加酚酞的NaOH溶液由红色变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 地壳中含量最多的元素 |
| Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | N能层上只有一个电子,K、L、M层均排满电子 |
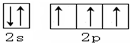 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com