
下列说法正确的是( )
A、燃料电池由外设装备提供燃料和氧化剂
B、Mg和Al通常用热还原的方法来冶炼
C、绿色化学的核心是应用化学原理对环境污染进行治理
D、蛋白质、棉花、淀粉、油脂都是由高分子组成的物质
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L二氯甲烷的分子数约为NA个
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol
C.17.6 g丙烷中所含的极性共价键为4NA个
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定体积的CO2通入到一定浓度的NaOH溶液中,为了测定其溶液的成分,向该溶液中逐滴加入1 mol/L盐酸。所加入盐酸的体积与产生二氧化碳气体体积(标准状况)的关系如图所示。
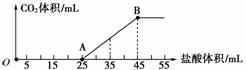
(1)写出OA段所发生反应的离子方程式:______________________________________ __________________________________________________________。
(2)当加入35 mL盐酸时,所产生的二氧化碳的体积(标准状况)是________mL。
(3)溶液中所含的物质有________________,其物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+ O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
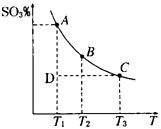
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
②若温度为T1时,反应进行到状态D时,V正_______V逆(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产中有重要作用。
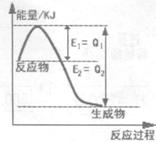
① 右图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:(△H用含字母Q1、Q2的代数式表示) 。
②在AlCl3溶液中滴加氨水,反应的离子方程式为: 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是 全品教学网, 用后离不了!,产生该现象的原因是(用离子方程式表示): 。
全品教学网, 用后离不了!(已知25℃时Ksp[AgCl] =1.0×10-10 mol2•L-2,Ksp[AgI] =1.5×10-16mol2•L-2 )
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
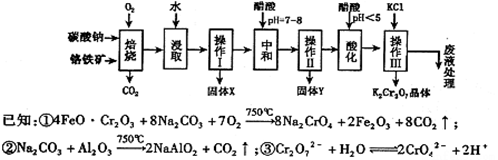
根据题意回答下列问题:
(1)操作Ⅰ的名称是 ,固体X中主要含有 (填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为 (写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+ 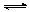 Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
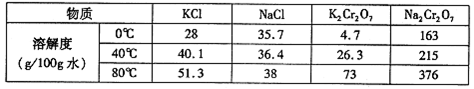
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是: 。
(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
 ①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
___Fe+___Cr2O72-+___ +___H2O =___Fe(OH)3↓+___Cr(OH)3↓+___H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10–32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052 mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于______。
(已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按如图所示的装置进行电解实验。下列说法不正确的是
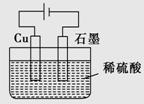
A.电解过程中,铜电极上有H2产生
B.电解初期,总反应方程式为Cu+H2SO4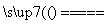 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,溶液pH值会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成42.0LN2(标准状况)
B.有0.250molKNO3被氧化
C.转移电子的物质的量为1.25mol
D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com