
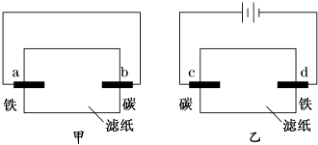
| A. | 滤纸上的阴离子都向碳棒迁移 | B. | a、d两极的电极反应式相同 | ||
| C. | b、d两极附近的溶液都变红 | D. | c、d两极均有少量气体产生 |
分析 甲构成原电池,乙为电解池,甲中铁发生吸氧腐蚀,正极上电极反应式为2H2O+O2+4e-=4OH-,乙中阴极上电极反应式为:2H++2e-=H2↑,水电离出的氢离子放电,导致阴极附近有大量OH-,溶液呈碱性,无色酚酞试液遇碱变红色,以此解答该题.
解答 解:A.甲为原电池,阴离子向负极移动,即向铁棒移动,故A错误;
B.a为负极,d为阴极,分别发生Fe-2e-=Fe2+、2H++2e-=H2↑,故B错误;
C.b为正极,发生2H2O+O2+4e-=4OH-,d为阴极,发生2H++2e-=H2↑,水电离出的氢离子放电,导致阴极d附近有大量OH-,溶液都变红,故C正确;
D.乙电解氯化钠溶液,阳极生成氯气,阴极生成氢气,故D正确.
故选CD.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生淀粉分析能力的考查,明确各个电极上发生的电极反应是解本题关键,再结合无色酚酞试液的特点来分析解答,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题

| A. | W点所示的溶液中:c(Na+)+c(H+)═2c(CO32-)+c(OH-)+c(Cl-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO32-)+c(CO32-)<0.1 mol•L-1 | |
| C. | pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)═c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3- )>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
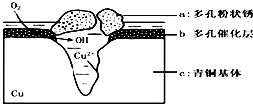 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极b被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145gCu 2 ( OH)3 Cl,则理论上消耗标准状况氧气体积为 0.448L | |
| D. | 正极的电极反应式为:正极反应是 O2+4e-+2H2O═4OH-- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
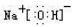 (写电子式,下同),既含有非极性共价键又含有离子键的化合物为
(写电子式,下同),既含有非极性共价键又含有离子键的化合物为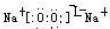 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 两种物质的分子式均为C10H14O2互为同分异构体 | |
| B. | 两种物质均能发生加成和取代反应 | |
| C. | 两种物质都有甲基、苯环和羧基 | |
| D. | 两物质都含有双键因此都能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com