
控制适合的条件,将反应2Fe3++2I- 2Fe2+I2,
2Fe2+I2,
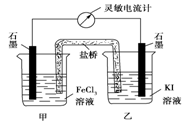
设计成如图所示的原电池。下列判断不正确的是
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
【知识点】氧化还原反应、原电池
【答案解析】D 解析:A.反应开始时,乙中石墨电极上碘离子失电子发生氧化反应,故A正确;B.反应开始时,甲中石墨电极上铁离子得电子发生还原反应生成亚铁离子,故B正确;C.电流计读数为零时,正逆反应速率相等,反应达到化学平衡状态,导致没有电流产生,故C正确;D.电流计读数为零后,在甲中溶入FeCl2固体,可逆反应向逆反应方向移动,导致乙中碘得电子发生还原反应,则乙中石墨作正极,故D错误;
故答案选D
【思路点拨】本题以化学平衡移动为载体考查了原电池原理,明确正负极的判断及正负极上电极反应式是解本题关键,注意等向甲中加入氯化亚铁溶液时,要考虑平衡移动方向,为易错点。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
实验室需要配制0 .50 mol/L NaCl溶液480 mL。
.50 mol/L NaCl溶液480 mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
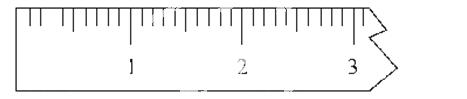
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是
________________________________________________________________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
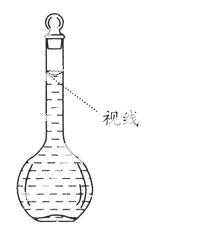
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“ 偏低” 或“无影响”)。
偏低” 或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示 H,则
H,则 H=____________________;
H=____________________;
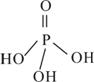
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为________________________________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)_____ Ni2+ + ____ H2PO2-+ _____ → ___Ni++______ H2PO3-+ ____
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:______________________________________________________;
原理上的不同点:______________________________________________________;
化学镀的优点:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是CO2电催化还原为CH4的工作原理示意图。下列说
法不正确的是
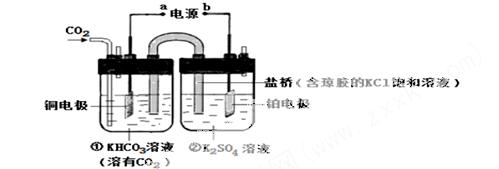
A.该过程是电能转化为化学能的过程
B.一段时间后,①池中n(KHCO3)不变
C.一段时间后,②池中溶液的pH 一定下降
D.铜电极的电极反应式为CO2+8H++8e- = CH4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
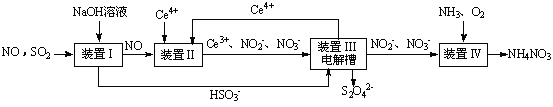
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
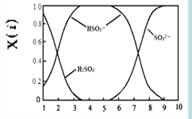
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。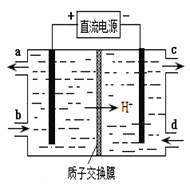
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
.下图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:
(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是_____。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越________(填“高”或“低”)钢铁越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为__________________________ 。
Ⅱ.利用化学反应:2FeCl3+Cu===2FeCl2+CuCl2 ,请你选择合适的电极材料和电解质溶液,设计一个原电池。可供选择的电极材料:铁棒、铜棒、石墨棒。
可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液。
请填写下列空白:
(1)选择_________作正极材料,_________作负极材料;选择____ __作电解质溶液。
(2)写出有关的电极反应式:正极:________________________________;
负极:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.有单质生成的反应一定是氧化还原反应
B.非金属的最高价含氧酸都具有强氧化性
C.两种不同的阴离子在溶液中一定能大量共存
D.同种物质中的同种元素在反应中可能既被氧化又被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是( )
A. 滤液A中的阳离子为Fe3+、Cu2+、H+
B. 样品中Fe元素的质量为2.24 g
C. 样品中CuO的质量为4.0 g
D. =896 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com