
(10分)试回答下列各问题:
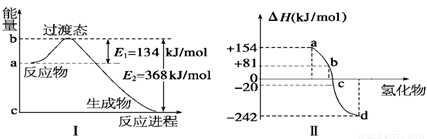
(1)如图Ⅰ所示是1 mol NO2和CO反应生成 CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g) === 2HCl(g) ΔH=-185 kJ/mol;
键能ΔH298(H—H)=436 kJ/mol,ΔH298(Cl—Cl)=247 kJ/mol,则ΔH298(H—Cl)= 。
②图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲生成氢化物时的焓变数据,根据这组焓变数据可确定a、b、c、d分别代表的元素,试写出硒化氢发生分解反应的热化学方程式: 。
(3)已知: ①Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ΔH=-a
kJ/mol
2Fe(s)+3CO2(g) ΔH=-a
kJ/mol
②3Fe2O3(s)+CO(g)
 2Fe3O4(s)+CO2(g)
ΔH=-b kJ/mol
2Fe3O4(s)+CO2(g)
ΔH=-b kJ/mol
③Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g) ΔH=+ckJ/mol
3FeO(s)+CO2(g) ΔH=+ckJ/mol
则FeO(s) +CO(g)  Fe(s)+CO2(g) ΔH=-
。
Fe(s)+CO2(g) ΔH=-
。
(1)NO2(g)+CO(g) === NO(g)+CO2(g) ΔH=-234 kJ/mol
(2)①434 kJ/mol。②H2Se(g) === Se(s)+H2(g) ΔH=-81 kJ/mol
(3) ΔH= - 1/6(3a-b+2c)kJ/mol
【解析】(1)根据图Ⅰ可知反应物的总能量高于生成物的总能量,是放热反应,放出的热量是368kJ/-134 kJ=234 kJ,所以热化学方程式为NO2(g)+CO(g) === NO(g)+CO2(g) ΔH=-234 kJ/mol。
(2)②反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此ΔH==436 kJ/mol+247 kJ/mo-2X=-185 kJ/mo,解得X=434 kJ/mol。
①非金属性越强,和氢气化合越剧烈,放出的热量就越多。所以a、b、c、d分别代表的元素是碲、硒(Se) 、硫、氧。生成硒化氢的反应是吸热反应,则逆反应就是放热反应,所以硒化氢发生分解反应的热化学方程H2Se(g) === Se(s)+H2(g) ΔH=-81 kJ/mol。
(3)根据盖斯定律可知,①×3-②-③×2即得到6FeO(s) +6CO(g)  6Fe(s)+6CO2(g),所以反应热为ΔH= -(3a-b+2c)kJ/mol。
6Fe(s)+6CO2(g),所以反应热为ΔH= -(3a-b+2c)kJ/mol。


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
有短周期A、B、C、D、E五种元素,它们的原子序数由A至E渐大。D的氢化物的分子式为H2D,D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等。A原子最外电子层上有4个电子。B的阴离子与C的阳离子和氖原子的电子层结构相同。E原子的M电子层上共有7个电子。常温常压下,B单质是气体,已知0.1mol的B单质与1.204×1023个H2完全反应。C单质在加热条件下与B单质反应生成淡黄色固体。根据上述情况,试回答下列各问题。
(1)A~E的元素符号分别为______、______、______、______、______。
(2)C单质和B单质在加热条件下生成化合物A2B2,写出反应的化学方程式:
_______________________________________;
写出A2B2与A的氧化物反应的化学方程式:
_______________________________________。
(3)试写出D、E最高价氧化物水化物分子式_________,_________,并比较酸性强弱________________;写出D、E气态氢化物分子式___________、___________,比较它们的稳定性________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)在某温度时,把 0.5mol N2O4 气体通入体积为5L的密闭容器中,2s时NO2的浓度为0.02mol.L-1,60s时达到平衡,此时容器内的压强为开始时的1.6倍。试回答下列各问题:
(1)2s时用N2O4浓度变化表示的化学反应速率是_________________。
(2)2s时,体系内的压强为开始时的 ________倍,此时N2O4的分解率为_______。
(3)达到平衡时,平衡混合物中N2O4的物质的量为____________,
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高一下学期期末考试化学试题 题型:填空题
(18分)有A、B、C、D、E、F六种短周期元素,原子序数依次增大,B、C、D的阳离子、A的阴离子均具有与氖原子相同的电子层结构;A、B可形成离子化合物B2A;D的最高价氧化物既能与强酸反应,又能与强碱反应;E的原子结构示意图为: ;F的最外层电子数是电子层数的2倍。
;F的最外层电子数是电子层数的2倍。
试回答下列各问题:
(1)B元素为 (填元素符号)
(2)F元素位于元素周期表中第 周期第 族
(3)化合物B2A的电子式____________________
(4)D的最高价氧化物与B的最高价氧化物对应的水化物溶液反应的离子方程式:
(5)将C、D用导线相连浸入B的最高价氧化物对应的水化物的溶液中,形成原电池,正极的电极反应为
查看答案和解析>>
科目:高中化学 来源:2012届贵州省高二上学期期末考试化学试卷 题型:填空题
(8分)在某温度时,把 0.5mol N2O4 气体通入体积为5L的密闭容器中,2s时NO2的浓度为0.02mol.L-1,60s时达到平衡,此时容器内的压强为开始时的1.6倍。试回答下列各问题:
(1)2s时用N2O4浓度变化表示的化学反应速率是_________________。
(2)2s时,体系内的压强为开始时的 ________倍,此时N2O4的分解率为_______。
(3)达到平衡时,平衡混合物中N2O4的物质的量为____________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com