

分析 (1)根据$\frac{△C}{△t}$和化学反应速率之比等化学计量数之比进行计算,得出正确结论;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,温度不变,则平衡常数K不变;
(3)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(4)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点.
解答 解:(1)v(SO2)=$\frac{6mol/L-2mol/L}{2min}$=2 mol•L-1•min-1;v(O2):v(SO2)=1:2,v(O2)=$\frac{1}{2}$v(SO2)=1mol•L-1•min-1,故答案为:1mol•L-1•min-1;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故:
可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g) 的平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,平衡常数只受温度的影响,温度不变,则压强不变,平衡状态由A变到B时,则k(A)=k(B),
故答案为:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;=;
(3)A.气体的总质量不变,随反应进行,气体的物质的量减小,平均相对分子质量增大,平均相对分子质量不变,说明到达平衡状态,故A正确;
B.平衡时接触室中SO2、O2的浓度一定不相同,开始物质的量为2:1,按2:1反应,平衡时二者的物质的量之比为2:1,浓度之比为2:1,故B错误;
C.平衡时接触室中SO2、O2、SO3物质的量之比可能为2:1:2,可能不是2:1:2,与二氧化硫的转化率有关,故C错误;
D.随反应进行,气体的物质的量减小,接触室中压强减小,压强不随时间变化而变化,说明到达平衡状态,故D正确;
故答案为:AD;
(4)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为 ,
,
故答案为:升温; 减小SO3浓度;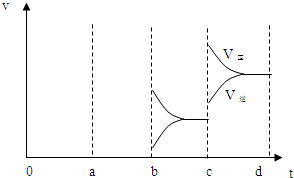 .
.
点评 本题考查化学反应速率与化学平衡的图象问题、平衡常数的计算、平衡状态的判断等,难度中等,注意把握曲线的变化趋势以及外界条件对化学平衡的影响.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 它的链节为
它的链节为 ,设其平均聚合度为3000,则该高聚物得平均相对分子质量为300 000.从结构角度看它应该属于线 型高分子.试推测有机玻璃能溶于CHCl3,具有热塑(填“热塑”或“固热”)性.
,设其平均聚合度为3000,则该高聚物得平均相对分子质量为300 000.从结构角度看它应该属于线 型高分子.试推测有机玻璃能溶于CHCl3,具有热塑(填“热塑”或“固热”)性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH逐渐减小 | B. | n(NH4+)增大 | ||
| C. | 恰好中和时水溶液显中性 | D. | Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com