
在元素周期表中,铝在硼的正下方,它们有很多相似的化学性质,可以形成许多组成和性质类似的化合物。单质硼可以通过硼镁矿Mg2B2O5·H2O来制取。
(1)写出步骤①的化学方程式 ,
(2)写出步骤②的离子方程式 ,
(3)写出表示溶液a物料守恒的关系 ;
(4)步骤③中加入稀H2SO4的作用是 ;
(5)将制得的粗硼在一定条件下反应全部生成BI3,BI3热分解可以得到纯净的单质硼。0.25 g粗硼制成的BI3分解得到的I2全部被收集后,用2.00 mol/L Na2S2O3溶液滴定,达到滴定终点时消耗27.00 mL Na2S2O3溶液。(已知:I2+2S2O32- 2I-+S4O62-)
2I-+S4O62-)
①滴定过程中所用的指示剂为 ,滴定终点的现象是 ;
②粗硼中硼的含量为____ ;
(6)利用硼砂晶体(Na2B4O7?10H2O)可制备过硼酸钠,它是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。已知纯净的过硼酸钠晶体中各元素的物质的量之比为以n(Na):n(B):n(H):n(O)=1:1:n:7。取过硼酸钠晶体在70℃以上加热将逐步失去结晶水,测得固体质量随温度的变化如图所示,则乃时所得晶体的化学式为 ,请写出简要的解题过程。
(1)Mg2B2O5·H2O+2NaOH = 2NaBO2+2Mg(OH)2↓(2分)
(2)2Na++4BO2-+2CO2+11H2O = Na2B4O7·10H2O↓+2HCO3-(2分)
(3)c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3) (2分)
(4)利用强酸制备弱酸H3BO3 (1分)
(5)①淀粉溶液(1分) 溶液由蓝色恰好变为无色(1分)
②79.2%(2分)
(6)NaBO3·H2O(1分)
解题过程 (3分)
解:T3时 n(Na)=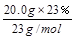 =" 0.2" mol (1分)
=" 0.2" mol (1分)
则30.80 g样品中,依n(Na)∶ n(B)∶n(H)∶n(O)=l∶1∶n∶7可得
0.2 mol × 23 g/mol + 0.2 mol × 11 g/mol + 0.2n × 1g/mol + 7 × 0.2 mol × 16 g/mol =" 30.80" g
解得n = 8
故原晶体为NaBO3·4H2O (1分)
设T3时晶体的化学式为NaBO3·mH2O
则由T3时晶体中钠元素的质量分数可得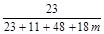 × 100% = 23%
× 100% = 23%
解得m = 1
所以T3时晶体的化学式为NaBO3·H2O(1分)
解析试题分析:(3)通入过量二氧化碳得到的是碳酸氢钠溶液,所以有c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3) 。
(5)①Na2S2O3溶液成碱性,S2O32-离子水解溶液显示碱性,反应的离子方程式为:S2O32-+H2O?HS2O3-+OH-;滴定过程中有碘单质参与,可以使用淀粉溶液作为指示剂;滴定结束时,锥形瓶中溶液蓝色褪去且30s内不褪色。
②硫代硫酸钠的物质的量为:2.00mol/L×0.027L=0.054mol,根据关系式:B~BI3~3/2I2~3S2O32-,n(B)=1/3n(S2O32-)=0.018mol,硼的质量为:11g/mol×0.018mol=0.1944g,粗硼中硼的含量为: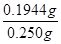 ×100%=79.2%,故答案为:79.2%;
×100%=79.2%,故答案为:79.2%;
考点:考查本题考查了盐类的水解、复杂化学式的计算等。


科目:高中化学 来源: 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是___________。
(2)上述流程中,工业上分离H2、CO2合理的方法是_____________________。
| A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸 |
| B.混合气加压冷却,使CO2液化 |
| C.混合气用氨水洗涤 |
| D.混合气先通入到石灰浆,然后高温煅烧固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下: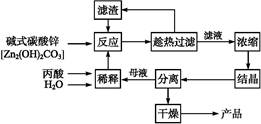
| 序号 | n(丙酸)∶ n(碱式碳酸锌) | 反应温度/℃ | 丙酸锌产率/% |
| 1 | 1∶0.25 | 60 | 67.2 |
| 2 | 1∶0.25 | 80 | 83.5 |
| 3 | 1∶0.25 | 100 | 81.4 |
| 4 | 1∶0.31 | 60 | 89.2 |
| 5 | 1∶0.31 | 80 | 90.1 |
| 6 | 1∶0.31 | 100 | 88.8 |
 ,反应温度 ℃。
,反应温度 ℃。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。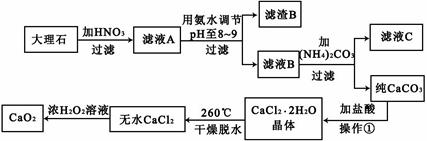
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
| 序号 | n(丙酸)∶ n(碱式碳酸锌) | 反应温度/℃ | 丙酸锌产率/% |
| 1 | 1∶0.25 | 60 | 67.2 |
| 2 | 1∶0.25 | 80 | 83.5 |
| 3 | 1∶0.25 | 100 | 81.4 |
| 4 | 1∶0.31 | 60 | 89.2 |
| 5 | 1∶0.31 | 80 | 90.1 |
| 6 | 1∶0.31 | 100 | 88.8 |
 ,反应温度 ℃。
,反应温度 ℃。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:

(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____ 。则“轻烧”温度应不超过 _____ 。
(2)流程图中“加热反应”的化学方程式为 _ _________________________ 。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______ (已知Ksp[Mg(OH)2]=5.61×10-12)。
(4)该工艺中可以循环使用的物质是 、 (填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石 的方法,其优点是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
分子筛具有均匀的微孔结构,分子筛筛分作用见下图。由于分子筛具有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用。某种型号的分子筛的工业生产流程可简单表示如下:

在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%。
(1)分子筛的孔道直径为4A(1 A=10-10m)称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应该选用 型分子筛。
(2)A12(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为 ;检验其中金属阳离子的操作方法是
(4)加NH3·H2O调节pH后,加热到90℃并趁热过滤的原因可能是
(5)该生产流程中所得分子筛的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器接触室(见图)。按此密闭体系中气体的流向,则在A处流出的气体为( )
| A.SO2 | B.SO3、O2 | C.SO2、SO3 | D.SO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO,下列叙述正确的是( )。
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3价 |
| D.氮化铝属于复合材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com