
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
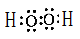 ⑹80 mL
⑹80 mL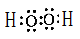 ;⑹丙为AlCl3,因为c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,所以 MgCl2的浓度为0.2 mol· L-1,即有0.04mol,AlCl3的浓度为0.3mol· L-1,即有0.06mol,当要使Mg2+全部转化为沉淀分离出来,即要把铝离子全部转化为偏铝酸根离子,即发生
;⑹丙为AlCl3,因为c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,所以 MgCl2的浓度为0.2 mol· L-1,即有0.04mol,AlCl3的浓度为0.3mol· L-1,即有0.06mol,当要使Mg2+全部转化为沉淀分离出来,即要把铝离子全部转化为偏铝酸根离子,即发生

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源:不详 题型:单选题
| 元素 | N | S | O | Si |
| 原子半径/10?-10m | 0.75 | 1.02 | 0.74 | 1.17 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化性强弱:Cl2<S | B.金属性强弱:K<Na |
| C.酸性强弱:H3PO4<H2SO4 | D.碱性强弱:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“四中子”的粒子不显电性 | B.“四中子”的质量数为4 |
| C.第二种粒子是氧元素的另一种同位素 | D.第二种粒子的化学式为O4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱金属元素的阳离子的氧化性随着原子序数的递增依次增强 |
| B.钾与氧气或水反应比钠的反应剧烈,铷、铯的反应更剧烈 |
| C.碱金属元素形成的单质的熔点随原子序数的递增而降低 |
| D.随着核电荷数的递增,他们最高价氧化物对应水化物的碱性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.XH4的沸点比YH3高 |
| B.X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |
| C.元素W的最高价氧化物对应水化物的酸性比Y的强 |
| D.X与Y形成的化合物的熔点可能比金刚石高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| X | Y | |
| | Z | W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属性强弱:Na>Mg>Al | B.酸性强弱:HIO4>HBrO4>HClO4 |
| C.碱性强弱:KOH>NaOH>LiOH | D.原子半径大小:Na>S>O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com