
| A. | 四种元素中离子半径最大的为M | |
| B. | Y、Z、M的氢化物中,M的氢化物沸点最高 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物,不能发生加成反应 |
分析 X、Y、Z、M为构成生命体的基本元素,即C、H、N、O,已知其原子序数依次增大,则X为H元素,Y为C元素,Z为N元素,M为O元素,据此结合元素化合物的性质和元素周期律分析解答.
解答 解:X、Y、Z、M为构成生命体的基本元素,即C、H、N、O,已知其原子序数依次增大,则X为H元素,Y为C元素,Z为N元素,M为O元素,
A.电子层越多,离子半径越大,电子层相同时,序小半径反而大,所以四种元素中C的离子半径最大,氢离子半径最小,故A错误;
B.虽然氧的氢化物分子间存在氢键,使沸点升高,在常温下是液态,但是碳的氢化物中有气态烃、液态烃、固态烃,故B错误;
C.四种元素可以形成碳酸铵、碳酸氢铵、硝酸铵等盐,故C错误;
D.由四种元素中的两种形成的相对分子质量最小的有机物为CH4,不能发生加成反应,故D正确.
故选:D.
点评 本题考查原子结构和元素周期律,明确元素周期律内涵是解本题关键,熟练掌握元素周期律并灵活运用,题目难度不大,侧重于考查学生对基础知识的应用能力.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:填空题
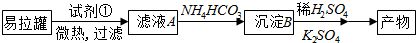
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 根据原子核外电子排布的特点,Zn在周期表中属于ds区元素 | |
| B. | P4和CH4都是正四面体形分子且键角都为109°28′ | |
| C. | NH3分子中N原子和H2O分子中O原子的杂化类型不相同 | |
| D. | 原子间只通过共价键而形成的三维网状结构的晶体一定具有高的熔、沸点及硬度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 酚酞具有弱酸性,且属于芳香烃 | |
| B. | 酚酞的分子式为C19H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 0.1 mol/L的氨水中加少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 常温下,0.1 mol/L一元酸(HA)溶液的 pH=3,则该溶液中,c2(H+)=c(H+)×c(A-)+Kw | |
| C. | 向含有 1 mol KAl(SO4)2 的溶液中加入 Ba(OH)2 溶液得到沉淀的物质的量最多为 2 mol | |
| D. | 将 Ca(ClO)2、Na2SO3、FeCl3、NaAlO2 溶液蒸干均得不到原溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
. .
. 、CH3CH2OH和
、CH3CH2OH和 为原料,合成
为原料,合成 ,写出合成流程图(无机试剂任用).
,写出合成流程图(无机试剂任用).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com