
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
分析 由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、F为氧、G为Cl、H为Br、R为Ar.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强;稀有气体原子最外层为稳定结构,化学性质最不活泼;由E的位置可知其处于第二周期ⅣA族;
(2)非金属性越强,最高价氧化物对应水化物的碱性越强;
(3)H的氢化物为HBr;利用单质之间的相互置换反应进行验证;
(4)D的原子序数为13,F的原子序数为8.
解答 解:由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、F为氧、G为Cl、H为Br、R为Ar.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中K的金属性最强;稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;由E的位置可知其处于第二周期ⅣA族,
故答案为:K;Ar;二;ⅣA;
(2)金属性Na>Mg>Al,非金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,含有离子键、共价键,
故答案为:NaOH;离子键;共价键;
(3)H的氢化物为HBr,结构式为H-Br;利用单质之间的相互置换反应进行验证,反应离子方程式为:Cl2+2NaBr=2NaCl+Br2,
故答案为:H-Br;Cl2+2NaBr=2NaCl+Br2;
(4)D的原子序数为13,F的原子序数为8,二者原子序数之差为13-8=5,故答案为:5.
点评 本题考查元素周期表与元素周期律的综合应用,比较基础,注意对元素周期表的整体把握.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池两极均发生氧化还原反应 | |
| C. | 原电池中的阳离子向正极移动 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
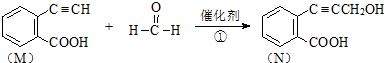
 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为
;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为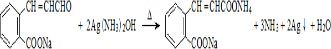 .
.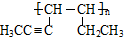
 ;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为
;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
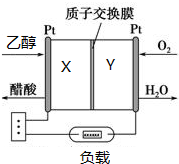 由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )
由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )| A. | Y极的电极反应式为O2+4e-+2H2O═4OH- | |
| B. | 电池放电时,H+由Y极区流向X极区 | |
| C. | 每消耗1mol乙醇,转移电子4mol | |
| D. | 用该电池做电源电解精炼铜,X极应与粗铜连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>c>d>b | B. | d>a>b>c | C. | d>b>a>c | D. | b>a>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431 kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)═0.225 mol/(L•min) | B. | v(H2O)═0.375 mol/(L•min) | ||
| C. | v(O2)═0.225 mol/(L•min) | D. | v(NH3)═0.450 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
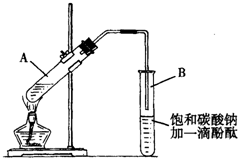 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | -- | 338.0 | 1.84 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com