
【题目】某研究性学习小组以甲酸为原料在实验室完成了一氧化碳和甲酸铜两种物质的制备实验。
实验一、用甲酸制备一氧化碳
CO的制备原理:HCOOH![]() CO↑+H2O,制备装置如下图(其中夹持仪器、加热仪器没有画出)
CO↑+H2O,制备装置如下图(其中夹持仪器、加热仪器没有画出)
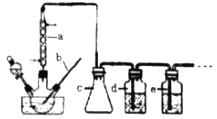
(1)b仪器的名称为___________,c的作用是___________。
(2)制备CO时,浓硫酸与甲酸的混合方式是___________。
实验二、用甲酸制备甲酸铜[Cu(HCOO)24H2O]
步骤一:碱式碳酸铜的制备
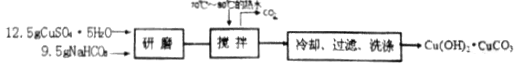
步骤二:甲酸铜的制备
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量甲酸至沉淀完全溶解,趁热过滤,滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)24H2O产品,称量,计算产率。回答下列问题:
左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)24H2O产品,称量,计算产率。回答下列问题:
(3)在制备碱式碳酸铜的过程中,如果温度过高,对产物有何影响?___________。
(4)步骤二中碱式碳酸铜滴入甲酸生成四水合甲酸铜的化学方程式为___________。
(5)本实验涉及三种固液分离的方法.
①倾析法使用到的仪器有___________;
②采用减压过滤的装置对步骤二中溶解后的溶液进行趁热过滤;
③步骤二的实验中,需用到下列装置___________

(6)最终称量所得的产品为7.91g,则产率为___________。
【答案】
(1)温度计;防倒吸
(2)先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸
(3)温度过高导致Cu(OH)2CuCO3分解;
(4)Cu(OH)2CuCO3+4HCOOH+5H2O═Cu(HCOO)24H2O+CO2↑
(5)①烧杯、玻璃棒;③ CDF
(6)70﹪
【解析】
试题分析:(1)根据装置图,b仪器是温度计,c是安全瓶,可以防止倒吸,故答案为:温度计;防倒吸
(2)反应中浓硫酸主要起催化剂和脱水剂的作用,,反应时首先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸,就会反应放出一氧化碳,故答案为:先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸;
(3)用于碱式碳酸铜不稳定,温度过高导致Cu(OH)2CuCO3分解生成黑色的氧化铜、二氧化碳气体和水,影响其产率,故答案为:温度过高导致Cu(OH)2CuCO3分解;
(4)碱式碳酸铜与甲酸反应制得蓝色四水甲酸铜的反应方程式为Cu(OH)2CuCO3+4HCOOH+5H2O═Cu(HCOO)24H2O+CO2↑,故答案为:Cu(OH)2CuCO3+4HCOOH+5H2O═Cu(HCOO)24H2O+CO2↑;
(5)①倾析法分离溶液时,选用使用到烧杯和用于引流的仪器玻璃棒,故答案为:烧杯、玻璃棒;
③根据甲酸铜的制备步骤可知,需要减压过滤、趁热过滤和蒸发装置,所以需要的装置有C、D、F,故答案为:CDF;
(6)12.5g硫酸铜晶体的物质的量为:![]() =0.05mol,9.5g碳酸氢钠的物质的量为:
=0.05mol,9.5g碳酸氢钠的物质的量为:![]() ≈0.113mol,根据反应2CuSO4+4NaHCO3═Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4+H2O可知,碳酸氢钠过量,反应生成的碱式碳酸铜的物质的量为0.05mol,根据反应Cu(OH)2CuCO3+4HCOOH+5H2O═Cu(HCOO)24H2O+CO2↑可知,生成甲酸铜的物质的量为0.05mol,所以甲酸铜的产率为:
≈0.113mol,根据反应2CuSO4+4NaHCO3═Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4+H2O可知,碳酸氢钠过量,反应生成的碱式碳酸铜的物质的量为0.05mol,根据反应Cu(OH)2CuCO3+4HCOOH+5H2O═Cu(HCOO)24H2O+CO2↑可知,生成甲酸铜的物质的量为0.05mol,所以甲酸铜的产率为:![]() ×100%=70%,故答案为:70%。
×100%=70%,故答案为:70%。


科目:高中化学 来源: 题型:
【题目】实验室用下图装置制取少量溴苯,试填写下列空白。
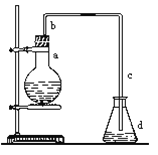
(1)在烧瓶a中装的试剂是铁粉、 和 。
(2)请你推测长直导管b的作用: ____ 。
(3)请你分析导管c的下口可否浸没于液面中?为什么?
。
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有 生成,
此现象说明这种获得溴苯的反应属于: 。(填有机反应类型)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是____________。
(2)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(3)已知高碘酸有两种形式,化学式分别为H5IO6(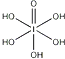 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4(填“>”、“<”或“=”)。
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4(填“>”、“<”或“=”)。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应:I-+I2═I3-.I3-的中心原子周围的σ键电子对对数为______ 。与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列________式发生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知CaF2晶体的密度为ρg·cm3,NA为阿伏加德罗常数,CaF2晶胞的边长为apm,则CaF2的相对分子质量可以表示为________________(用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是短周期元素的气态单质,其中A是黄绿色的气体单质,C在空气中含量最高,D是最轻的气体;E是一种最常用的金属;Y是一种常见的液态物质,Z是唯一显碱性的气体; M是一种红棕色的有毒气体;I为红褐色难溶于水的固体。有关的转化关系如下图所示(反应条件均已略去)。
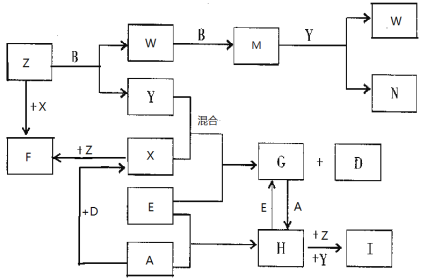
回答下列问题:
(1)A的组成元素在元素周期表的位置为 ;
(2)F中化学键的类型是 、 ;(每空2分,共4分)
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为 ;
(4)I为红褐色难溶于水的固体,与“84消毒液”的有效成分(NaClO) ,在浓碱溶液中发生反应生成了高效环保的净水剂高铁酸钠,请写出此反应的离子方程式 。
(5)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023,则参加反应的E的质量为
g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
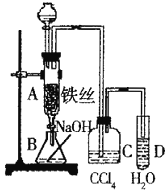
(1)写出A中反应的化学方程式______________________________;
(2)观察到D中的现象是______________________________;
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_______________;
(4)C中盛放CCl4的作用是______________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中先加入_________,再加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________,现象是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 和E同主族 |
C | lmo1C单质能与冷水反应,在标准状况下生成11.2LH2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1) A在周期表中的位置为 。
(2)B和C形成的化合物的电子式为 。
(3)B和D简单离子的半径大小为 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号)。
A.比较两种单质的颜色
B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置
D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A.催化剂V2O5不改变该反应的逆反应速率
B.恒压,通入稀有气体,反应速率不变
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是C1mol/L,C2 mol/L,则时间间隔t1(s)~t2(s)内,SO3(g)消耗的平均速率为 V=(C2-C1)/(t2-t1) mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224L HCl气体溶于635mL水中,所得盐酸的密度为1.18gcm-3.试计算:
(1)所得盐酸的物质的量浓度是_________;
(2)取出这种盐酸10mL,稀释至118mL,所得稀盐酸的物质的量浓度是_________。若用量筒取10mL盐酸时仰视,其他操作均正确,则稀盐酸浓度_________(填“偏大”、 “不变”或“偏小”)。
(3)在40.0mL 0.065molL-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_________ mL?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向某固定容积的密闭容器中加入1molCO(g)和1molH2O(g),发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。此反应达到平衡的标志是( )
CO2(g)+H2(g)。此反应达到平衡的标志是( )
A.体系的总压强不变
B.体系内各物质的质量分数不再发生变化
C.体系内气体密度不再发生变化
D.单位时间消耗0.1molCO(g)的同时生成0.1molH2O(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com