
(12分)Ⅰ.从下列各组反应对比,判断哪种微粒的氧化性最强。
(1)在氯气中Fe锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液FeCl2。则氯气分子、氢离子、氯离子中,__________具有氧化性,__________氧化性最强。请书写出以上各反应的化学方程式___________________________。
(2)已知在ⅣA族元素中,Pb2+和Sn4+的化合物较为稳定。
据此可判断PbO2具有较强的________性,SnCl2具有较强的________性;写出PbO2溶于盐酸的离子方程式____________________;写出SnCl2和FeCl3溶液混合的离子方程式_______________________________________
Ⅱ.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40°C~50°C时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式:________________。
(3)CuH溶解在稀盐酸中生成的气体是____________(填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式: ______________________________。
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
(12分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
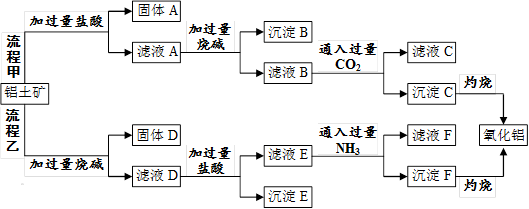
请回答下列问题:
⑴流程甲中,固体A的主要成分是______(填化学式,下同),沉淀B的主要成分是_______,生成沉淀C的离子方程式为__________________。
⑵流程乙中,加过量烧碱时发生反应的离子方程式为________________,沉淀E的主要成分是_________。
⑶生成沉淀F的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省汕头市金山中学高二10月月考化学试卷(带解析) 题型:填空题
(12分)写出下列反应的热化学方程式。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(2)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
(3)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧热的热化学方程式
查看答案和解析>>
科目:高中化学 来源:鲁必修1第3章 自然界中的元素练习 题型:实验题
(12分)从某物质A的水溶液出发有如图所示的转化关系: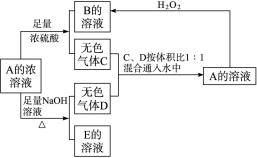
回答下列问题:
(1)写出C、D、E的化学式:C________,D________,E________。
(2)检验B溶液中阴离子的实验操作和实验现象是
________________________________________________________________________。
(3)写出下列反应的离子方程式:
①A+足量NaOH溶液
________________________________________________________________________。
②C、D按体积比1∶1通入水中
________________________________________________________________________。
③A+H2O2―→________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届广东省汕头市高二10月月考化学试卷(解析版) 题型:填空题
(12分)写出下列反应的热化学方程式。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(2)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
(3)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧热的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)I.下列是四组同学用铜制取硫酸铜晶体的方案:
甲组:将铜粉投入盛有稀硫酸的容器中,无反应。向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快。
![]()
![]() 乙组: Cu CuO CuSO4
乙组: Cu CuO CuSO4
![]()
![]()
![]() 丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
![]() 丁组: Cu CuSO4
丁组: Cu CuSO4
(1)甲组实验用一个化学反应方程式表示: ;
使反应变快的可能原因是 ;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的实验操作步骤应为 、
过滤并洗涤晶体,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在四组方案中, 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:
CuSO4![]() CuO+SO2↑+SO3↑+O2↑
CuO+SO2↑+SO3↑+O2↑
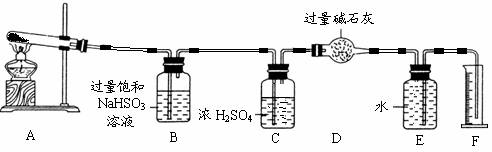 为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO4;
②实验结束时干燥管D总质
量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL。试回答下列问题:
(3)装置B的作用是 。
(4)装置C的作用是 。
(5)为减少测量气体体积引起的误差,应注意的事项有:
① 装置内气体的温度应恢复到室温,
② 调节量筒使其液面与E装置中的液面持平,
③ 。
(6)通过计算,推断出该条件下反应的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com