
| A. | 铁制品锈蚀时主要发生析氢腐蚀 | |
| B. | 施用适量石膏可以降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| C. | 电镀厂未经处理的废水可以直接用来灌溉农田 | |
| D. | 将水坝的钢铁闸门与直流电的正极相连可以防闸门腐蚀 |
分析 A、铁制品的锈蚀主要是由吸氧腐蚀引起的;
B、盐碱地(含较多NaCl、Na2CO3)的碱性是由碳酸根的水解引起的;
C、电镀厂未经处理的废水中含有大量的重金属离子;
D、在电解池中,阳极被腐蚀,阴极被保护.
解答 解:A、由于空气形成的水膜大多数显中性或弱酸性,故铁制品的锈蚀主要是由吸氧腐蚀引起的,故A错误;
B、盐碱地(含较多NaCl、Na2CO3)的碱性是由碳酸根的水解引起的,故加入石膏CaSO4•2H2O后,能将Na2CO3中的CO32-沉淀为碳酸钙,从而降低盐碱地的碱性,故B正确;
C、电镀厂未经处理的废水中含有大量的重金属离子,不能直接灌溉农田,故C错误;
D、在电解池中,阳极被腐蚀,阴极被保护,故应将钢铁闸门连接直流电的负极,故D错误.
故选B.
点评 本题考查了金属的电化学腐蚀和防护,难度不大,应注意的是金属的腐蚀主要是由电化学腐蚀中的吸氧腐蚀引起的.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将铁钉投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26g乙炔所含共用电子对数目为3NA | |
| B. | 标准状况下,11.2L三氯甲烷所含的分子数为0.5NA | |
| C. | 一定条件下,2.6g乙炔、苯和苯乙烯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1mol甲基含10NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 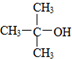 的命名:2,2-二甲基-2-乙醇 的命名:2,2-二甲基-2-乙醇 | |
| C. | 常温下,浓度都为0.1mol•Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者 | |
| D. | 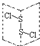 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.
前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:
已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25.4ρ | B. | 12.7ρ | C. | 6.97ρ | D. | 6.35ρ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com