
 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )| A. | 溶液中H+的移动方向由A极到B极 | |
| B. | 电池总反应方程式为:2SO2+O2+2H2O=2H2SO4 | |
| C. | 正极电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol |
分析 SO2-O2形成燃料电池,通O2的电极B为正极发生还原反应,反应式为:O2+4H++4e-=2H2O,通SO2的电极A为负极发生氧化反应,反应式为:SO2+2H2O-2e-=SO42-+4H+,阳离子由负极移向正极,据此分析计算.
解答 解:A.SO2-O2形成燃料电池,通O2的电极B为正极,通SO2的电极A为负极,所以溶液中H+的移动方向由A极到B极,故A正确;
B.通O2的电极B为正极反应式为:O2+4H++4e-=2H2O,通SO2的电极A为负极反应式为:SO2+2H2O-2e-=SO42-+4H+,所以总反应方程式为:2SO2+O2+2H2O=2H2SO4,故B正确;
C.通O2的电极B为正极发生还原反应,反应式为:O2+4H++4e-=2H2O,故C错误;
D.当有0.25mol SO2被吸收,电子转移0.5mol,依据电子守恒分析通过质子(H+)交换膜的H+的物质的量为0.5mol,故D正确.
故选C.
点评 本题考查了原电池原理,明确各个电极上发生的电极反应是解本题关键,难点是电极反应式的书写,要注意结合电解质溶液酸碱性书写,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 放电过程中,正极的电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时,电子由负极→正极→电解质溶液→负极,形成闭合回路 | |
| C. | 充电时,阴极附近溶液pH 降低 | |
| D. | 充电过程中,OH-从阳极向阴极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为:Li-e-=Li+ | |
| B. | 正极反应式为:FeS2+4e-=Fe+2S2- | |
| C. | 电池放电时K+向正极移动 | |
| D. | 可用KCl、LiCl的水溶液做电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
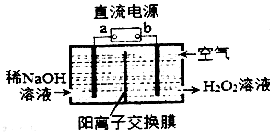 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
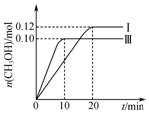 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )| 容器 | 温度/℃ | 起始物质的量/mol | ||
| CO(g) | H2(g) | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0 |
| Ⅱ | T1 | 0 | 0 | 0.4 |
| Ⅲ | T2 | 0.2 | 0.4 | 0 |
| A. | 在前20 min内,容器Ⅰ中反应的平均速率为v(H2)=0.012 mol•L-1•min-1 | |
| B. | 达到平衡后,容器Ⅰ中再充入0.20 mol CO和0.20 mol CH3OH,此时v(正)>v(逆) | |
| C. | 达到平衡时,容器Ⅱ中的压强一定大于容器Ⅰ中的压强的两倍 | |
| D. | 将容器Ⅲ改为绝热容器,实验起始温度为T2,达到平衡时,CO的转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
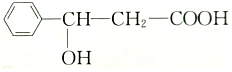 ,对该有机物的下列说法中正确的是( )
,对该有机物的下列说法中正确的是( )| A. | 含有羟基、苯基、羧基三种官能团 | B. | 属于芳香烃 | ||
| C. | 在一定条件下,能发生酯化反应 | D. | 属于羧基,也属于酚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{19}^{40}$K 与${\;}_{19}^{39}$K | B. | T2O与H2O | ||
| C. | CH3CH2CH2CH3与 | D. | CH3CH3与CH3CH3CH3 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:实验题
某同学按下列步骤配制500 mL 0.20 mol·L-1KCl溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需KCl的质量 |
|
(2)称量KCl固体 | 称量过程中主要用到的仪器是__________ |
(3)将KCl加入100 mL烧杯中,加适量蒸馏水溶解 |
|
(4)将烧杯中的溶液转移至500 mL容量瓶中,洗涤2至3次并将洗涤液转入容量瓶中 | 为防止溶液溅出,应该采取的措施是______________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______________________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com