
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
分析 (1)MnO2在酸性溶液中分别和CuS和FeS发生氧化还原反应,Mn元素的化合价降低,S元素的化合价升高,且Fe元素化合价升高;
(2)滤液A中含金属离子,加Zn发生置换反应;
(3)由转化可知,铁离子、铝离子转化为沉淀;
(4)步骤④中电解过程中MnO2应在阳极生成,因Mn元素失去电子,阴极上Zn得到电子,得到的硫酸可循环使用.
解答 解:(1)MnO2在酸性溶液中分别和CuS和FeS发生氧化还原反应,Mn元素的化合价降低,S元素的化合价升高,且Fe元素化合价升高,由电子、原子守恒可知,反应分别为MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、3MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O,
故答案为:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O;3MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O;
(2)由滤液A$\stackrel{步骤②:金属棒}{→}$Zn2+、Mn2+、Fe2+、Al3+,可知加Zn置换出Cu、Cd,故答案为:Cu、Cd;
(3)由转化可知,铁离子、铝离子转化为沉淀,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+;另外一种固体物质可为Zn(OH)2(Mn(OH)2、ZnCO3、MnCO3等)促进铁离子水解转化为沉淀,
故答案为:将Fe2+氧化为Fe3+;Zn(OH)2;
(4)因Mn元素失去电子,可知步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+,硫酸根离子不变,且生成氢离子,可知产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用,
故答案为:阳;Mn2+-2e-+2H2O=MnO2+4H+;H2SO4;用于溶解软锰矿和闪锌矿,循环使用.
点评 本题考查混合物分离提纯的综合应用及物质制备实验,为高频考点,把握简化流程中的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
 在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )
在一定温度和压强条件下发生了反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )| A. | P3>P2T3>T2 | B. | P2>P4T4>T2 | C. | P1>P3T3>T1 | D. | P1>P4T2>T3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加水稀释后所有的离子浓度均减小 | |
| B. | 与等体积等浓度的盐酸反应后,有:c(NH3.H2O)+c(OH-)=c(H+) | |
| C. | 加入等浓度的盐酸到pH=7时,有:c(NH4+)+c(NH3.H2O)=c(Cl-) | |
| D. | 该溶液在与盐酸完全中和的过程中,H2O的电离度不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是一种物理量 | |
| B. | 溶液中或熔融状态下能导电的物质就是电解质 | |
| C. | 氧化还原反应的本质是元素化合价发生了变化 | |
| D. | 得电子的物质被还原,是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| B | 向AgI悬浊液中滴加NaCl溶液 | 不出现白色沉淀 | 更难溶的物质无法转化为难溶的物质 |
| C | 向KI溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈紫色 | I-还原性强于Cl- |
| D | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
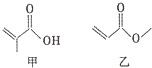
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能与溴的单质发生加成反应 | |
| C. | 一定条件下,甲、乙均能发生取代反应 | |
| D. | 甲、乙都能与金属钠反应生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大气中PM2.5比表面积大,吸附力强,能吸附许多有毒有害物质 | |
| B. | 在厨房里可用米汤检验加碘食盐中的碘 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
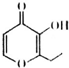 俗称“一滴香”的物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C8H8O3 | |
| B. | 1 mo1该有机物最多能与 2 mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成和氧化反应 | |
| D. | 该有机物能与碳酸氢钠反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
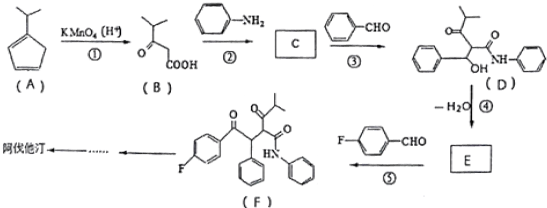
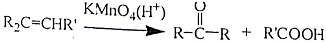 R、R′代表烃基)
R、R′代表烃基)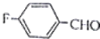 的名称对氟苯甲醛.
的名称对氟苯甲醛.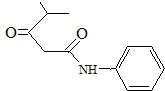 .
.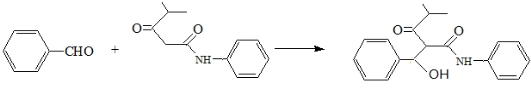 .
.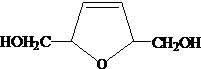 .
.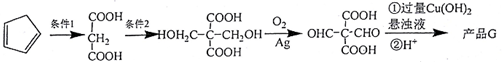
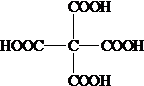 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com