
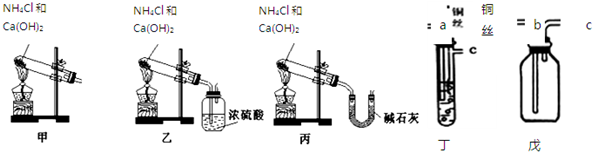
 2NH3��
2NH3������ ��1���Ȼ�������������ڼ��������·�Ӧ���ɰ������Ȼ��ơ�ˮ��
��2���������ܶȱȿ�����С���������ſ������ռ���
��3����û���ռ�����������Ϊ����ͨ��Ũ����ᱻ���գ�
��4������Ϊ�������壬��ˮ��Ӧ����NH3•H2O�������ӳ�OH-���ӣ���Һ�ʼ��ԣ���������ʪ��ĺ�ɫʯ����ֽ���飬Ҳ���ð������Ȼ��ⷴӦ���ɰ��̼��飻
��5����ҵ���õ�����������ȡ������
��1��ѡ�ã�һ���ж�����װ�����Ʊ����ռ������������壬��������Ϊ�ܶȴ��ڿ��������壻
��2��Cu��Ũ���ᷴӦ��������ͭ��NO2��ˮ��
��3��NO2������Ⱦ���������ܱ���Һ���գ�
��4��������ȫ��Ӧ��������������NO������n=$\frac{V}{{V}_{m}}$����NO�����ʵ��������ݵ���ת���غ����μӷ�Ӧ��n��Fe�����ɵ�Ԫ���غ��֪��n��HNO3��=2n[Fe��NO3��2]+n��NO�����ٸ���c=$\frac{n}{v}$���㣮
��� �⣺��1������װ�����Լ�������֪�������ù����Ȼ�狀��������ƹ�����ȷ�Ӧ���ɰ�������Ӧ�Ļ�ѧ����ʽΪ2NH4Cl+Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
�ʴ�Ϊ��2NH4Cl+Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
��2���������ܶȱȿ�����С���������ſ������ռ���������Ӧ���ռ�װ�õĶ̵����ܽ��룬�����ռ�װ�õ�C�˵��ܽ��룬
�ʴ�Ϊ��c��
��3 ������û���ռ�����������Ϊ����ͨ��Ũ����ᱻ���գ�
�ʴ�Ϊ���ң�
�ڰ���ͨ��Ũ����ᱻ���գ������ķ�Ӧ�ǣ�2NH3+H2SO4�T��NH4��2SO4��
�ʴ�Ϊ��2NH3+H2SO4�T��NH4��2SO4��
�ۼ�װ�÷ֽ�õ����ǻ�����壬�ò���������������װ�÷ֽ�õ�������̼�Ͱ���ˮ�����������ͨ��Ũ���ᰱ�������յò���������װ�ñ�װ�÷ֽ�õ�������̼�Ͱ���ˮ�����������ͨ����ʯ�ң����ն�����̼��ˮ�����õ��������就����
�ʴ�Ϊ������
��4������Ϊ�������壬��ˮ��Ӧ����NH3•H2O�������ӳ�OH-���ӣ���Һ�ʼ��ԣ�����ʱ��ʪ���ʯ����ֽ�ŵ��Թܿڣ������ɫ��˵���Թ�C���Ѽ���NH3���������Ȼ��ⷴӦ���ɰ����Ȼ�泥�����Ҳ���ò�����պȡŨ���ᣬ�����Թܿڣ����д����������ɣ�˵���Թ�C���Ѽ���NH3��
�ʴ�Ϊ����ʪ���ʯ����ֽ�ŵ��Թܿڣ������ɫ��˵���Թ�C���Ѽ���NH3�������ò�����պȡŨ���ᣬ�����Թܿڣ����д����������ɣ�˵���Թ�C���Ѽ���NH3����
��5����ҵ���õ����������ڸ��¸�ѹ����������ȡ��������ӦΪ��N2+3H2 2NH3��
2NH3��
�ʴ�Ϊ��N2+3H2 2NH3��
2NH3��
��1��ͭ˿��Ũ���ᷴӦ���ɶ������������������ܶȱȿ������賤�����ܽ��룬������ȷ������˳��Ϊabc��
�ʴ�Ϊ��abc��
��2��Cu��Ũ���ᷴӦ��������ͭ��NO2��ˮ����Ӧ���ӷ���ʽΪ��Cu+4H++2NO3-=Cu2++2NO2��+2H2O��
�ʴ�Ϊ��Cu+4H++2NO3-=Cu2++2NO2��+2H2O��
��3��NaOH��Һ��NO2��Ӧ�Ļ�ѧ����ʽΪ��2NaOH+2NO2=NaNO2+NaNO3+H2O�����Կ�ѡ������������Һ���գ�
�ʴ�Ϊ������������Һ��
��4��������ȫ��Ӧ��������������NO��NO�����ʵ���=$\frac{0.448L}{22.4L/mol}$=0.02mol�����ݵ���ת���غ㣬�μӷ�Ӧ��n��Fe��=$\frac{0.02mol��3}{2}$=0.03mol���ɵ�Ԫ���غ��֪��n��HNO3��=2n[Fe��NO3��2]+n��NO��=2��0.03mol+0.02mol=0.08mol����ԭ��������ʵ���Ũ��=$\frac{0.08mol}{0.1L}$=0.8mol/L��
�ʴ�Ϊ��0.8mol/L��
���� ���⿼���˰����������������Ʊ������ʵļ��飬��ȷ�����Ʊ�ԭ�������������ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S2-���ӵĽṹʾ��ͼ��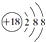 | B�� | H2O2�ĵ���ʽ��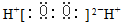 | ||
| C�� | CO2�ı���ģ�ͣ�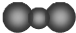 | D�� | ��8�����ӡ�10�����ӵĺ��أ�188O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
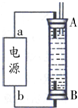 ̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��
̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������� | B�� | �������� | C�� | þ�� | D�� | ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ֽ����������ͷ����ķ�Ӧ�Ƿ��ȷ�Ӧ | |
| B�� | 1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��270kJ | |
| C�� | ����ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF��������� | |
| D�� | ���ȷ�Ӧ�ķ�Ӧ�������Ǵ������ȷ�Ӧ�ķ�Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ�� pH��7 | |
| B�� | ����Һ�����ȣ�K1��K2 ͬʱ���� | |
| C�� | ������Һ���м��������� NaOH ��Һ����Һ�� pH �������� | |
| D�� | ������Һ���м��� 5 mL 0.1 mol•L-1 �����ᣬ����Һ�д���� K1 ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ɱ������� | |
| B�� | ���ȷ�Ӧ | |
| C�� | ��ˮ�������������Ȼ�粒����ĩ��� | |
| D�� | ͭ��Ũ���ᷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com