
【题目】在真核细胞中,DNA存在于( )
A. 细胞核中 B. 细胞质中
C. 细胞核和细胞质中 D. 细胞核、线粒体、叶绿体中
科目:高中化学 来源: 题型:
【题目】下列反应中可用来设计成原电池的是( )
A. CaO +H2O===Ca(OH)2 B. NaOH+HCl===NaCl+H2O
C. 2KClO3![]() 2KCl+3O2↑ D. Zn+2HCl===ZnCl2+H2↑
2KCl+3O2↑ D. Zn+2HCl===ZnCl2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能为( )
①x+2 ②x+4 ③x+16 ④x+26 ⑤x+32
A.①⑤B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前4min的平均反应速率υ(Z)=0.0125 molL﹣1min﹣1
B.其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( ) 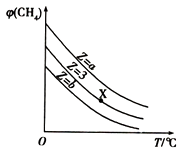
A.该反应的焓变△H<0
B.图中Z的大小为a<3<b
C.图中X点对应的平衡混合物中 ![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是


A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4+Al(OH)3
D. C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等. 已知①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5kJmol﹣1
则CO气体还原Fe2O3(s)的热化学方程式为 .
(2)将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.850℃时, 该反应的平衡常数K=1.
①该反应的平衡常数表达式为 .
②若反应的容器容积为2.0L,反应进行4.0min时,容器内气体的物质的量减少了0,8mol,这段时间内υ(CO2)= .
③850℃时,若向1.0L的密闭容器中同时充入3.0molCO2(g)、1.0mol H2(g)、1.0mol CH3OH(g)和
5.0mol H2O(g),上述反应向(填“正反应”或“逆反应”)方向进行.
④若上述反应的平衡常数K值增大,该反应(填序号).
a.一定下正反应方向移动 b.一定下逆反应方向移动
c.在平衡移动过程中正反应速率先增大后减小 d.在平衡移动过程中逆反应速率先减小后增大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
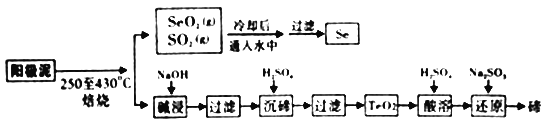
已知: (1)TeO2是两性氧化物。
(2)Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)“培烧”时,为提高原料的利用率,可采取的措施有_________(写一条即可)。
(2)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(3)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为______________。
(4)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是______________。
(5)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有10mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),理由是_______________。(已知25℃时,亚硒酸(HSeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com