
 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) | 褪色时间(S) | ||
| C(mol•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
分析 (1)根据仪器构造可知;反应生成的气体与C中氢氧化钠溶液反应,容易发生倒吸现象,装置B为安全瓶,起到了防止倒吸的作用;
(2)淀粉遇碘变蓝色,在已经水解的淀粉溶液中滴加几滴碘液,溶液显蓝色,则证明淀粉没有完全水解,溶液若不显色,则证明淀粉完全水解;
(3)酸性高锰酸钾溶液具有强氧化性,能够将草酸氧化,据此写出反应的离子方程式;
(4)对比试验1和试验2的反应条件的区别,可以得出影响化学反应速率的因素;
(5)①判断沉淀是否洗净的方法:取最后一次洗涤的滤液,检测滤液中是否存在未洗涤干净的杂质,本题中草酸亚铁的制备是用FeSO4•7H2O固体于小烧杯中加入水和少量稀H2SO4溶液酸化,加热溶解,因而沉淀表面可能会有稀H2SO4杂质,因而应该检验最后一次洗涤滤液中是否含有SO42-,即该题便转化成SO42-的检验;
②用丙酮洗涤两次并晾干,丙酮易挥发,草酸亚铁不溶于丙酮,有利于干燥,减少损失.
解答 解:(1)根据仪器构造可知仪器乙为冷凝管;硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O,装置C吸收尾气,装置B为安全瓶,防止C中液体倒吸进A中;
故答案为:冷凝管;防C中液体倒吸进A中(安全瓶);
(2)淀粉遇碘变蓝色,方法为:取样,加碘水,看是否变蓝,变蓝则证明水解不完全,否则,完全;
故答案为:取样,加碘水,看是否变蓝,变蓝则证明水解不完全,否则,水解完全;
(3)酸性高锰酸钾具有强氧化性,草酸能够被氧化,导致酸性高锰酸钾溶液褪色,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2+2Mn2++8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
(4)通过两组实验比较知,其它条件相同,试验2中加入硫酸锰,其反应时间短,说明反应速率快,从而证明反应生成的Mn2+有催化作用,加快了反应速率;
故答案为:Mn2+起了催化剂的作用;
(5)①本题中草酸亚铁的制备是用FeSO4•7H2O固体于小烧杯中加入水和少量稀H2SO4溶液酸化,加热溶解,因而沉淀表面可能会有稀H2SO4杂质,因而应该检验最后一次洗涤滤液中是否含有SO42-,具体操作为:取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
故答案为:取最后一次洗涤液1~2mL置于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
②丙酮易挥发,草酸亚铁不溶于丙酮,降低草酸亚铁的溶解量,同时更快洗去表面的水分;
故答案为:降低草酸亚铁的溶解量,同时更快洗去表面的水分.
点评 本题考查了制备实验方案设计,涉及化学实验、物质的性质,题目难度中等,注意掌握探究物质性质实验方案设计的方法,明确物质性质及实验操作方法为解答关键,试题有利于提高学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述稀释过程中,H2A分子及所有离子浓度均减小 | |
| B. | 上述稀释过程中,$\frac{{c(HA}^{-})}{{c(H}_{2}A)}$的变化趋势保持增大 | |
| C. | 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-) | |
| D. | 根据H2A的电离常数,可推知0.1mol•L-1NaHA溶液的pH值大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
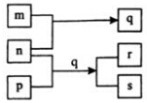 元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )
元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径的大小W<X<Z | B. | W的氧化物常温常压下为液态 | ||
| C. | Y的氧化物可能呈黑色或红棕色 | D. | Z的氧化物的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
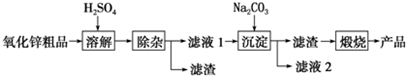
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白酒 | B. | 纯碱溶液 | C. | 食盐溶液 | D. | 柠檬酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
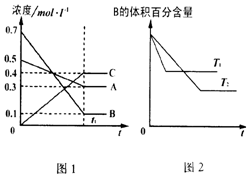
| A. | 在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动 | |
| B. | 保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| C. | T℃时,若由0.4mol•L -1A、0.4mol•L -1B、0.2mol•L -1C反应,达到平衡后,C的浓度为0.8mol•L -1 | |
| D. | 在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com