
【题目】无色气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,下列说法正确的是( )

A. 甲气体肯定有NO2
B. 经过浓硫酸处理后余气中NO、CO2体积比为2:3
C. 甲气体的组成可能为NH3、NO、NO2
D. 经过Na2O2处理后剩余气体体积大于80mL
【答案】B
【解析】
NO2是红棕色的气体,浓硫酸可以和NH3反应,CO2可以和过氧化钠反应生成氢氧化钠和氧气,一氧化氮无色,与氧气立即反应变为红棕色的二氧化氮,氮气不溶于水,将100mL甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,说明无氮气,据此分析解答。
无色气体甲一定不含有红棕色的NO2气体,所以选项A、C错误;硫酸和碱性气体NH3能反应,所以100mL甲气体经过足量的浓硫酸,剩余气体80mL,说明一定含有20mLNH3;CO2可以和过氧化钠反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,反应后无色气体变为红棕色气体,说明有NO、CO2,最后用排水法收集气体,广口瓶被上升的水注满,说明没有N2,则根据方程式4NO2+O2+2H2O=4HNO3可知:n(NO2):n(O2)=4:1,结合2NO+O2=2NO2,2Na2O2+2CO2=2Na2CO3+O2,可知n(NO):n(CO2)=4:2(2+1)=2:3,选项B正确;由于通过浓硫酸后气体体积为80mL,再通过Na2O2时发生反应2Na2O2+2CO2=2Na2CO3+O2,该反应是气体体积减小的反应。且气体变为红棕色,同时还发生了反应:2NO+O2=2NO2,这个反应也是气体体积减小的反应,所以经过Na2O2处理后剩余气体体积小于80mL,选项D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
Ⅰ. ①液氨、氨气 ②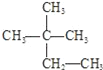 、
、 ![]() ③金刚石、C60 ④
③金刚石、C60 ④![]() 、
、![]()
上述四组物质中,互为同分异构体的是_____,互为同素异形体的是_____;属于同种物质的是___________(填序号)。
Ⅱ.现有以下五种物质:a.NH4Cl b.水晶 c.Na2O2 d.干冰 e.C60请用相应字母填空:
(1)属于分子晶体的是____________;
(2)属于共价化合物的是______________;
(3)熔化时只需要破坏共价键的是_____________;
(4)既含有离子键又含有共价键的是__________________;
(5)物质b与e相比,硬度较小的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述不正确的是
A. 氧化镁(熔点2800℃)是优质的耐高温材料
B. 还原铁粉可用作食品袋内的抗氧化剂
C. 高炉炼铁过程中用石灰石与二氧化硅反应形成炉渣
D. 晶体硅是一种半导体材料,常用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在下列转化关系中,烃A为石油的裂解气里含量较高的气体(碳元素的质量分数为0.857),B分子中含有三元环,分子式为C2H4O;1molD与足量Zn反应生成22.4LH2(标准状况);E为六元环化合物。请回答下列问题:
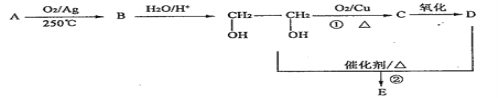
(1)A 的结构简式____________。
(2)①的反应类型为___________。
(3)D中官能团的名称是____________。
(4)写出反应②的化学方程式___________。
Ⅱ、化合物W可用作高分子膨胀剂,一种合成路线如下:
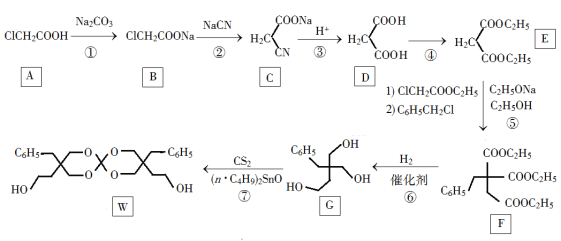
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)G的分子式为________。
(4)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。(写出一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人们认为苯是一种不饱和烃,但是苯不能使溴水褪色,性质类似烷烃,写出苯与液溴发生取代反应的化学方程式__________________________________
(2)某烷烃碳架结构如图所示:![]() ,此烷烃的一溴代物有_________种;若此烷烃为单烯烃加氢制得,则此烯烃的结构有__________种。
,此烷烃的一溴代物有_________种;若此烷烃为单烯烃加氢制得,则此烯烃的结构有__________种。
(3)某有机物由C、H、O三种元素组成,球棍模型如图所示: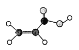 。写出此有机物与金属钠反应的化学方程式_________________________________
。写出此有机物与金属钠反应的化学方程式_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )

①X、Y的最高价氧化物的水化物酸性为Y<X;②Y、Z的气态氢化物的稳定性Y<Z;③W的单质常温下呈液态,一定条件下可与铁粉反应;④W的原子序数比Z大9。
A. 只有③ B. ①② C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu、Ag都能溶解在硝酸中,某同学设计如下实验测量m g铜银合金样品中铜的质量分数,下列说法中正确的是( )
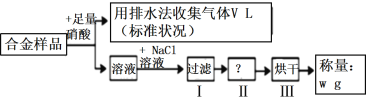
A. 被Cu还原的硝酸为![]() molB. 操作I所用到的玻璃仪器是烧杯、蒸发皿、玻璃棒
molB. 操作I所用到的玻璃仪器是烧杯、蒸发皿、玻璃棒
C. 操作Ⅱ为蒸发D. 铜的质量分数为![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | c | |||||||||||||||
e | f | ||||||||||||||||
试回答下列问题:
(1)写出元素e的基态原子电子排布式________________,其未成对电子数为________。
(2)c在空气中燃烧产物的分子构型为_____,中心原子的杂化形式为______杂化。c能形成一种八元环状形同王冠的单质分子,原子的杂化形式为______杂化。
(3)b单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
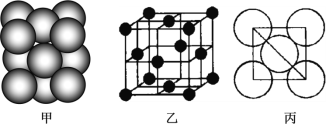
若已知b的原子半径为d厘米,NA代表阿伏加德罗常数,b的相对原子质量为M,请回答:
①晶胞中b原子的配位数为_____,表示原子空间占有率的代数式为_____________。
②该晶体的密度为_____________g/cm3(用含有关字母的代数式表示)。a、f中,与单质b晶体中原子的堆积方式相同的是__________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。对于C60与棒碳,下列说法正确的是
A.C60与棒碳中所有的化学键都是非极性共价键
B.棒碳不能使溴水褪色
C.C60在一定条件下可能与CuO发生置换反应
D.棒碳与乙炔互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com