
一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 | |
| 腐蚀快慢 | 较快 | 慢 | 较快 | |||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | ||||
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
全世界短年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是
| A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池 |
| B.金属棒X的材料应该是比镁活泼的金属 |
| C.金属棒X上发生反应:M一ne一——Mn+ |
| D.这种方法称为牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铜板上铁铆钉处的腐蚀原理如图所示,下列有关说法中正确的是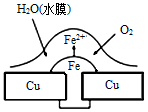
| A.此过程中铜被腐蚀 |
| B.此过程中电子从Cu移向Fe |
| C.正极电极反应式为O2+2H2O+4e-=4OH- |
| D.铁钉表面发生的反应为Fe-3e- ═ Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关电化学原理的推断正确的是
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH- |
| C.氯碱工业中,阳极发生的反应为:2Cl-–2e→Cl2↑ |
| D.镀锌铁皮的镀层损坏后,铁更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示(上端为多孔电极a,下断为多孔电极b),该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法不正确的是
| A.工作时电极b作正极,O2-由电极b流向电极a |
| B.工作时电子由电极a通过介质流向电极b |
| C.负极的电极反应式为:CO+O2—―2e-=CO2 |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是
| A.该处理过程中电能转化为化学能 |
| B.银器为正极,Ag2S还原为单质银 |
| C.Ag2S溶解于食盐水生成了AgCl |
| D.铝质容器为阳极,其质量变轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
利用下图装置电解硫酸铜溶液,下列说法正确的是
| A.b电极上发生氧化反应 |
| B.该装置能将化学能转变成电能 |
| C.电解质溶液中Cu2+从b电极向a电极迁移 |
| D.若a为铜,则a的电极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲 阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 +Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 | B.负极的电极反应式为:Pb+SO42--2e– = PbSO4 |
| C.PbO2得电子,被氧化 | D.电池放电时,溶液酸性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com