
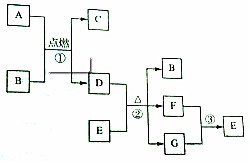
 有关物质的转化关系如图所示(部分物质和条件已略去).A是金属单质,D是非金属单质,B、F是气体且B无色无味,G是最常见的无色液体.请回答下列问题:
有关物质的转化关系如图所示(部分物质和条件已略去).A是金属单质,D是非金属单质,B、F是气体且B无色无味,G是最常见的无色液体.请回答下列问题: ;
; .
. 分析 A是金属单质,D是非金属单质,说明是金属置换非金属,点燃条件下符合的为A为Mg,B为CO2,D为C,C为MgO,B、F是气体且B无色无味,G是最常见的无色液体,推断为水,D+E加热反应生成水、二氧化碳、另一种气体溶于水得到E,则判断E为HNO3,F为NO2,
(1)C为氧化镁;
(2)B为二氧化碳属于共价化合物,碳原子和两个氧原子间分别写出两个共价键;
(3)反应③是二氧化氮和水反应生成硝酸和一氧化氮;
(4)反应②是碳和浓硝酸加热反应生成二氧化氮、二氧化碳和水,碳元素化合价0价变化为+4价,氮元素化合价+5价变化为+4价,电子转移总数为4e-.
解答 解:(1)C为氧化镁化学式为MgO,故答案为:MgO;
(2)B为二氧化碳属于共价化合物,碳原子和两个氧原子间分别写出两个共价键,电子式为:CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,其电子式为 ,故答案为:
,故答案为: ;
;
(3)反应③是二氧化氮和水反应生成硝酸和一氧化氮,反应的离子方程式为:3NO2+H2O=2H++2NO3-+NO,
故答案为:3NO2+H2O=2H++2NO3-+NO;
(4)反应②是碳和浓硝酸加热反应生成二氧化氮、二氧化碳和水,C+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O,碳元素化合价0价变化为+4价,氮元素化合价+5价变化为+4价,电子转移总数为4e-,单线桥标出电子转移的方向和数目为:为 ,
,
故答案为: .
.
点评 本题以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语、离子方程式书写等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题

| A. | 已知该步转化过程中的原子利用率为100%,则X为CO2 | |
| B. | 有机物F属于芳香族化合物,但不属于芳香烃 | |
| C. | (C9H8O3)n既是高分子G的化学式也是其链节的化学式 | |
| D. | 已知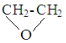 经水解生成乙二醇,则F、G在一定条件下水解,可得相同的产物 经水解生成乙二醇,则F、G在一定条件下水解,可得相同的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 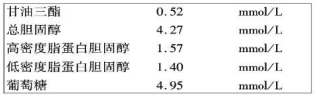 如图是一张体检血液化验单,化验单表示该体检指标的物理量是物质的量 | |
| B. | 水和四氯化碳可以用分液漏斗分离 | |
| C. | 烧杯、试管、蒸发皿、圆底烧瓶、蒸馏烧瓶都可用酒精灯加热 | |
| D. | 98%的浓硫酸,密度为 1.84g/mL,其物质的量浓度为 18.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Cu2+、Fe2+氧化性依次减弱 | |
| B. | 可发生反应:Fe+2Fe3+═3Fe2+ | |
| C. | Fe、Fe2+、Cu还原性依次减弱 | |
| D. | 将铁、铜混合粉末放入FeCl3溶液中,铁粉先溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴水中使溴水褪色 | |
| B. | 乙烯使酸性高锰酸钾溶液褪色 | |
| C. | 四氯化碳与溴水混合振荡,静置后溴水褪色 | |
| D. | 乙烷与Cl2光照条件下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率的大小主要由浓度、温度、压强等外界因素决定 | |
| B. | 化石燃料是不可再生能源,生物质能是可再生能源 | |
| C. | 许多水果与花卉的芳香气味是因含有酯的原因 | |
| D. | 人工合成尿素,彻底动摇了“生命力论”,使有机化学迅猛发展 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com