
分析 (1)A.碲是52号元素原子核外有5个电子层,最外层6个电子;
B.和硫元素类比分析存在的氧化物;
C.同主族最高价氧化物对应水化物酸性减弱;
D.同主族氢化物稳定性减弱,同周期氢化物稳定性增强;
(2)亚碲酸(H2TeO3)是二元弱酸分步电离,0.1mol•L-1H2TeO3的电离度 a可以依据第一步电离计算,Ka1=$\frac{{x}^{2}}{0.1-x}$,解得x≈0.01,电离度=$\frac{0.01}{0.1}$×100%=10%,NaHTeO3的溶液中存在电离和水解平衡,水解平衡常数Kh=$\frac{c(O{H}^{-})c({H}_{2}Te{O}_{3})}{c(HTe{{O}_{3}}^{-})}$=$\frac{c(O{H}^{-})c({H}_{2}Te{O}_{3})}{c(HTe{{O}_{3}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{1}}$=$\frac{1{0}^{-14}}{1×1{0}^{-3}}$=10-11<K2=2×10-8;
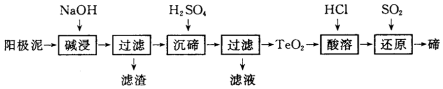
(3)TeO2微溶于水,易溶于较浓的强酸和强碱.工业上常用铜阳极泥(主要含有Te02、少量Ag、Au)为原料制备单质碲,阳极泥主要含有Te02、少量Ag、Au加入氢氧化钠Te02溶解,过滤得到滤渣为不溶于碱的Ag、Au,滤液中加入硫酸沉碲过滤得到TeO2,加入盐酸溶解后通入二氧化硫还原得到金属碲,
①TeO2是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应,碱浸”时TeO2和氢氧化钠溶液反应生成NaTeO3和水;
②因为TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失;
③SO2还原TeCl4为Te,本身被氧化为硫酸,根据得失电子守恒书写.
④阳极泥碱浸、过滤后的滤液中是Na2TeO3的溶液,惰性电极电解溶液阴极上是TeO32-离子得到电子生成Te,结合氢氧根离子配平电荷守恒得到电极反应.
解答 解:(1)A.碲是52号元素原子核外有5个电子层,最外层6个电子,周期表中第五周期ⅥA族,故A错误;
B.和硫元素类比分析存在的氧化物为通常有TeO2和TeO3,故B正确;
C.同主族最高价氧化物对应水化物酸性减弱,H2Te04的酸性比H2SO4酸性弱,故C错误;
D.同主族氢化物稳定性减弱,热稳定性H2Te比H2S弱,同周期氢化物稳定性增强,H2Te比HI弱,故D错误;
故答案为:ACD;
(2)25℃时,亚碲酸(H2TeO3)的 Ka1=1×10-3,K2=2×10-8,H2TeO3?H++HTeO3-,Ka1=$\frac{c({H}^{+})c(HTe{{O}_{3}}^{-})}{c({H}_{2}Te{O}_{3})}$=$\frac{{c}^{2}({H}^{+})}{0.1}$=10-3,c(H+)=10-2mol/L,
0.1mol•L-1H2TeO3的电离度 a 约为:$\frac{1{0}^{-2}}{0.1}$×100%=10%,NaHTeO3的溶液中存在电离和水解平衡,水解平衡常数Kh=$\frac{c(O{H}^{-})c({H}_{2}Te{O}_{3})}{c(HTe{{O}_{3}}^{-})}$=$\frac{c(O{H}^{-})c({H}_{2}Te{O}_{3})}{c(HTe{{O}_{3}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{1}}$=$\frac{1{0}^{-14}}{1×1{0}^{-3}}$=10-11<K2=2×10-8,说明HTeO3-水解程度小于其电离程度,溶液显酸性,
故答案为:10%;<;
(3)根据TeO2是两性氧化物,微溶于水,加碱溶过滤除去杂质,得到Na2TeO3溶液,再加硫酸沉降经过滤得到TeO2沉淀,再用盐酸溶解生成四氯化碲,再用二氧化硫还原制成碲单质;
①TeO2是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应,化学方程式为TeO2+2NaOH=Na2TeO3+H2O,
故答案为:TeO2+2NaOH=Na2TeO3+H2O;
②因为TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失;防止局部酸度过大的操作方法是:缓慢加入H2SO4,并不断搅拌
故答案为:TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失;缓慢加入H2SO4,并不断搅拌;
③SO2还原TeCl4为Te,本身被氧化为硫酸,化学方程式为TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4,
故答案为:TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4;
④阳极泥碱浸、过滤后的滤液中是Na2TeO3的溶液,惰性电极电解溶液阴极上是TeO32-离子得到电子生成Te,结合氢氧根离子配平电荷守恒得到电极反应为:TeO32-+3H2O+4e-=Te+6OH-,故答案为:TeO32-+3H2O+4e-=Te+6OH-.
点评 本题考查了原子结构、弱电解质电离平衡、盐类水解、电解原理等知识点,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.
某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.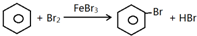 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.2mL和1.8mL | B. | 5.6mL和4.4mL | C. | 6.4mL和3.6mL | D. | 3.5mL和6.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 向冰醋酸中逐滴加水,醋酸的电离度和pH先增大后减小 | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 25℃时,在CH3COOH溶液与NaCN溶液中,水的电离程度前者大 | |
| D. | amol•L-1HCN溶液与bmol•L-1NaOH溶液等体积混合,所得溶液中c(Na+)<c(CN-),则b一定小于a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展清洁能源 | B. | 增加植被面积 | C. | 燃烧煤炭供热 | D. | 选择绿色出行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有相同质子数的微粒一定属于同一种元素 | |
| B. | H2O和H2O2互为同素异形体 | |
| C. | 含有金属元素的离子不一定是阳离子 | |
| D. | 同种元素的原子中,中子数和质子数一定都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>X | |
| B. | 含氧酸的酸性:W>Z | |
| C. | 气态氢化物的稳定性:W<Y | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
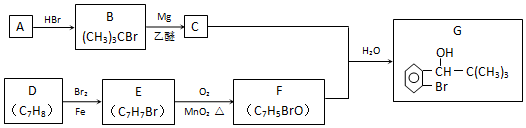

 ;F的结构简式为
;F的结构简式为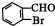 .
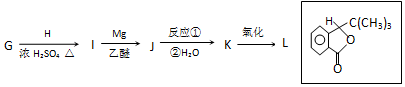
.
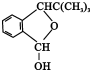 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com