
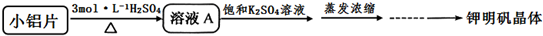
| 温度(℃) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| K2SO4 | 7.4 | 9.2 | 11.1 | 12.97 | 14.8 | 16.6 | 18.17 | 19.8 | 21.4 | 22.4 | 24.1 |
| Al2(SO4)3•18H2O | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 | 59.2 | 66.2 | 73.1 | 86.8 | 89.0 |
| KAl(SO4)2•12H2O | 3.0 | 4.0 | 5.9 | 8.4 | 11.7 | 17.0 | 24.8 | 40.0 | 71.0 | 109.0 | 154.0 |
分析 (1)烃类化合物易燃烧、易溶于有机溶剂、易被砂纸打磨掉;
(2)氢离子浓度大,反应速率快,但浓硫酸使Al钝化;从溶液中提取溶质晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;温度在64.5℃时钾明矾晶体会失去9分子结晶水;
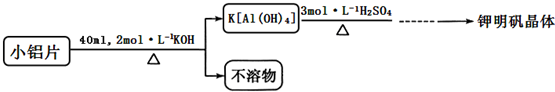
(3)方案一加硫酸溶解时,Mg、Fe均转化为易溶性的硫酸盐,方案一中反应速率较慢;K[Al(OH)4]和H2SO4反应会生成K2SO4;
(4)根据铝原子守恒计算出理论上2克铝完全转化得到KAl(SO4)2•12H2O的理论质量,再用钾明矾晶体实际质量除以理论值即得到产率.
解答 解:(1)易拉罐表面漆膜(主要成分为烃类化合物),烃类化合物易燃烧、易溶于有机溶剂、易被砂纸打磨掉,所以为了去除易拉罐表面漆膜可以采用灼烧、砂纸打磨、有机溶荆浸泡等方法,烃类化合物难溶于饱和碳酸钠溶液浸泡;
故答案为:B;
(2)浓度越大反应速率越大,则硫酸浓度不能过稀,过稀反应速率过慢,但是浓硫酸能使铝钝化,所以浓度也不能过高;从溶液中提取溶质晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;温度在64.5℃时钾明矾晶体会失去9分子结晶水,所以干燥晶体是时应控制温度64.5℃以下;
故答案为:硫酸浓度过稀反应速率过慢,浓度过高会使铝片钝化;冷却结晶、过滤;64.5℃以下;
(3)方案一加硫酸溶解时,Mg、Fe均转化为易溶性的硫酸盐,制备得到的所以钾明矾晶体中含有较多的杂质;铝与稀硫酸的反应速率较慢,所以方案一中反应速率较慢;
K[Al(OH)4]和H2SO4反应会生成K2SO4,不需要再加入K2SO4饱和溶液,其反应的离子方程为:2K[Al(OH)4]+4H2SO4=K2SO4+Al2(SO4)3+8H2O;
故答案为:①方案一制备晶体中含有较多铁镁硫酸盐等杂质;②方案一反应速率较慢;2K[Al(OH)4]+4H2SO4=K2SO4+Al2(SO4)3+8H2O;
(4)设2克铝完全反应生成的钾明矾晶体质量为x,则:
Al~~~~KAl(SO4)2•12H2O
27 474
2g x
则x=$\frac{2g×474}{27}$=35.1g,
所以钾明矾产率为$\frac{31.5g}{35.1g}$×100%=89.7%;
故答案为:89.7%.
点评 本题考查了物质的制备实验,涉及实验方案评价、实验条件的选择、离子方程式的书写、产率计算等,题目难度中等,题目考查的知识点较多,侧重于基础知识应用的考查和实验探究能力的考查.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 | |
| B. | 洗涤胶头滴管时,只要在水龙头的流水中,滴头朝上,胶头朝下不断挤压胶头即可 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 云母是热的不良导体.传热不均匀 | |
| B. | 石蜡是热的不良导体.传热不均匀 | |
| C. | 石蜡具有各向异性,不同的方向导热性不同 | |
| D. | 云母具有各向异性,不同的方向导热性不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 3,3,4,4-四甲基庚烷 | D. | 3,5-二甲基乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+═H2O+CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1828年德国化学家维勒首次在实验室里合成了尿素 | |
| B. | 19世纪初,瑞典化学家贝采利乌斯首次使用“有机”一词,并提出了“有机化学”和“有机化合物”的概念 | |
| C. | 1965年我国科学家人工合成了具有生物活性的蛋白质--结晶牛胰岛素 | |
| D. | 1830年,德国化学家李比希创立了有机化合物的定量分析方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com