
| ||
| 10g |
| 2g/mol |
| 1 |
| 2 |
| ||
| 1 |
| 2 |


科目:高中化学 来源: 题型:
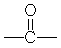 )上的加成反应,写出该反应产物的结构简式
)上的加成反应,写出该反应产物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(稀硝酸)<n(烧碱)<n(盐酸) |
| B、n(烧碱)<n(盐酸)<n(稀硝酸) |
| C、n(烧碱)<n(稀硝酸)<n(盐酸) |
| D、n(盐酸)<n(稀硝酸)<n(烧碱) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中由水电离的氢离子浓度为1×10-11mol/L:K+、Na+、SO42-、NO3- |
| B、使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- |
| C、0.1mol?L-1 AgNO3 溶液:H+、K+、SO42-、I- |
| D、0.1mol?L-1 NaAlO2 溶液:H+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5.2的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
| B、在滴有酚酞溶液的氨水里,加入盐酸至溶液恰好无色,则此时溶液的pH=7 |
| C、若100mLpH=11的NaOH溶液与10mL盐酸混合后溶液的pH=7,则盐酸溶液的pH=2 |
| D、某醋酸溶液的pH=3,将此溶液稀释10倍后溶液的pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
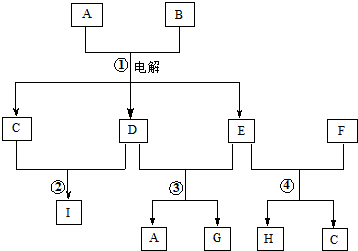
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | (1)A的相对分子质量为: |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为: |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). | (3)用结构简式表示A中含有的官能团: |
| (4)A的核磁共振氢谱如下图: | |
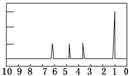 |
(4)A中含有 |
| (5)综上所述,A的结构简式 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| ||
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.25mol Na2O2中含有的阴离子数为0.5NA |
| B、1mol α-氨基乙酸(甘氨酸)分子中存在10NA对共用电子 |
| C、标准状况下,2.24L CHCl3含有的分子数为0.1NA |
| D、足量铜与1L 18mol?L-1浓硫酸反应可以得到SO2的分子总数为9NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com