
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/ml | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
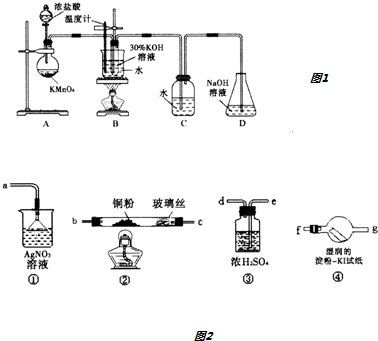
分析 (1)装置A中玻璃仪器为圆底烧瓶和分液漏斗;因为该反应是放热反应,生成的氯气中含有HCl,HCl易和NaOH发生中和反应;
(2)用浓硫酸除去气体中的水蒸气,该洗气装置中导气管应该遵循“长进短出”原则,然后用Cu除去氯气,用湿润的KI试纸检验氯气是否除净,最后用硝酸银检验HCl;
(3)根据表中数据知,混合后只有硫酸浓度不同,由此得知其研究目的是探究硫酸浓度对反应产物的影响;
只有对比实验才能得出正确结论;
(4)①酸的酸性越强,其对应的钠盐溶液pH越小;
②次氯酸或氯气可被SO2、H2O2、和FeCl2等物质还原成Cl-,可以用双氧水等物质将氯气和次氯酸转化为氯离子,然后用硝酸银将氯离子转化为AgCl沉淀,从而得出氯元素总量.
解答 解:(1)装置A中玻璃仪器为圆底烧瓶和分液漏斗;因为该反应是放热反应,生成的氯气中含有HCl,HCl易和NaOH发生中和反应,为了提高氯气和NaOH反应产率,可以先用水除去HCl,所以可能提高B中氯酸钾的产率,
故答案为:分液漏斗;可能;
(2)用浓硫酸除去气体中的水蒸气,该洗气装置中导气管应该遵循“长进短出”原则,然后用Cu除去氯气,用湿润的KI试纸检验氯气是否除净,最后用硝酸银检验HCl,其连接顺序是e、d、b、c、f、g,如果④中淀粉-KI试纸不变蓝色,说明不含氯气,装置①中产生白色沉淀,说明含有HCl,
故答案为:e;d;b;c;f;g;④中淀粉-KI试纸不变蓝色,装置①中产生白色沉淀;
(3)根据表中数据知,混合后只有硫酸浓度不同,由此得知其研究目的是探究硫酸浓度对反应产物的影响;
只有对比实验才能得出正确结论,所以设计1号试管实验的作用是硫酸浓度为0的对比实验,
故答案为:研究反应体系中硫酸浓度对反应产物的影响;硫酸浓度为0的对比实验;
(4)①酸的酸性越强,其对应的钠盐溶液pH越小,所以其实验方法为配制相同物质的量浓度的碳酸钠和次氯酸钠溶液,用pH计分别测定两种溶液的pH值,pH值越大的其对应的酸越弱,
故答案为:配制相同物质的量浓度的碳酸钠和次氯酸钠溶液,用pH计分别测定两种溶液的pH值;
②次氯酸或氯气可被SO2、H2O2、和FeCl2等物质还原成Cl-,可以用双氧水等物质将氯气和次氯酸转化为氯离子,然后用硝酸银将氯离子转化为AgCl沉淀,从而得出氯元素总量,所以实验方法为,
故答案为:量取一定量的试样,加入足量的双氧水溶液,充分反应后,加热除去过量的双氧水,冷却,再加入足量的硝酸银溶液,过滤,洗净烘干后称量沉淀质量,计算可得氯元素总量.
点评 本题考查化学性质实验设计,为高频考点,侧重考查学生分析判断、获取信息解答问题能力、实验设计能力等,明确实验原理、物质性质、实验操作等是解本题关键,难点是设计实验,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱可除去炊具上的油污 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为O2+4e-═2O2- | |
| B. | 放电时溶液中的阳离子向正极方向移动 | |
| C. | 该电池反应为CH4+2O2═CO2+2H2O | |
| D. | 通入CH4一极的电极反应式为CH4+2O2+8e-═CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收10L空气中的CO2(标准状况) | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4gCu在足量的硫蒸气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LSO2和SO3的混合物中硫原子数为0.5NA | |
| C. | 1L0.1mol•L-1的NH4Cl溶液中NH4+数目为0.1NA | |
| D. | 通常情况下,3.4gNH3中共用电子对数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
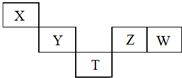 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )| A. | YW4与H2在高温下反应主要生成YH4和HW | |
| B. | X的原子半径比T原子半径小,两者原子序数之差为29 | |
| C. | W氧化物的水化物的酸性一定强于Z的氧化物的水化物 | |
| D. | T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com