
| A. | 电解饱和食盐水制烧碱,NaOH在阳极区域产生 | |
| B. | 合成氨生成过程中,采用高温高压都是为了提高N2、H2的转化率 | |
| C. | 给铁钉镀铜时,用铜做阴极 | |
| D. | 用明矾净水是因为Al3+水解生成的Al(OH)3胶粒具有很强的吸附性 |
分析 A、在电解池的阳极上是阴离子氯离子发生失电子的氧化反应;
B、合成氨生成过程中,采用高温会使平衡逆向移动,高压会使平衡正向移动;
C、铁钉镀铜时,镀件是阴极,镀层金属是阳极,电镀液是含有镀层金属阳离子的盐溶液;
D、Al3+水解生成的Al(OH)3胶粒具有很强的吸附性,可以净水.
解答 解:A、在电解池的阳极上是阴离子氯离子发生失电子的氧化反应,在阴极上是氢离子放电,所以氢氧化钠是在阴极上产生,故A错误;
B、合成氨生成过程中,采用高温会使平衡逆向移动,高压会使平衡正向移动,只有高压是可以提高N2、H2的转化率,故B错误;
C、铁钉镀铜时,镀件Fe是阴极,镀层金属Cu是阳极,电镀液是含有镀层金属阳离子的盐溶液,故C错误;
D、明矾净水是明矾电离出的铝离子Al3+水解生成的Al(OH)3胶粒具有很强的吸附性,可以净水,故D正确.
故选D.
点评 本题考查学生电解池的工作原理以及盐的水解原理的应用知识,注意知识的归纳和梳理是关键,难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 | c(A)/(mol•L-1) | c(B)/(mol•L-1) | c(C)/(mol•L-1) |
| 0min | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++HCO3- | B. | H2SO4=2H++SO42- | ||
| C. | Na2S=Na22++S2- | D. | NaHSO4=Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾制备实验中,将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可以分离出硝酸钾 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 减压过滤操作时,应将滤纸放入布氏漏斗内,滤纸大小应略大于漏斗内径才能将全部小孔盖住 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
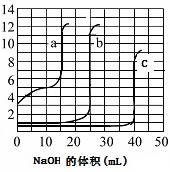
| A. | 由图可知曲线c为NaOH滴定盐酸 | |
| B. | 由图可知曲线a为NaOH滴定盐酸 | |
| C. | 滴定实验可用紫色石蕊试液做指示剂 | |
| D. | 由图可知曲线b为NaOH滴定盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amolX,同时生产4amolZ | |
| B. | 容器内的氧气不再变化 | |
| C. | Z的生成速率与Y的生成速率比值为1:2 | |
| D. | 容器内气体的密度不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.
如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com