
【题目】阿司匹林铜具有很强的抗炎作用。它是一种亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂中。易受热分解成浅绿色混合物。在强酸条件下能解离出铜离子。合成阿司匹林铜,其实验流程如下:
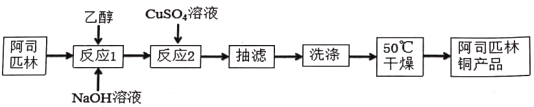
已知反应方程式如下:
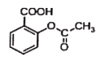 +NaOH→
+NaOH→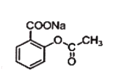 +H2O
+H2O
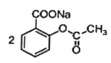 +CuSO4→
+CuSO4→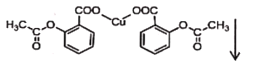 +Na2SO4
+Na2SO4
(1)下列有关说法正确的是_____。
A.反应1中加乙醇作溶剂,目的是增大接触面积,加快反应速率
B.用倾析法将反应2中的液体和沉淀同时转移到布氏漏斗中进行抽滤
C.洗涤操作中,可先用水洗2-3次,再用酒精洗涤2-3次
D.干燥后发现固体呈浅绿色,可能是烘干温度过高造成的结果
(2)反应1中的反应温度要求控制在室温的理由是______。
(3)阿司匹林铜中铜含量的测定,可用碘量法测定:
步骤一:准确称取0.800g样品,置于250mL锥形瓶中,加4mL3.00mol/L,再加20mL水,加热煮沸,样品完全分解后,摇匀,冷却到室温。
步骤二:往溶液中加入1.200gKI摇匀,用0.100mol/LNa2S2O3标准溶液滴定至溶液变浅黄色时,加入10mL 10% KSCN试剂,并加几滴淀粉溶液,继续用0.100mol/LNa2S2O3标准溶液滴定至终点,共消耗溶液体积为23.00mL。
已知:CuI难溶于水,能吸附碘;I2+2S2O32-=S4O62-+2I-。
CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①实验中加入10mL 10%KSCN试剂的目的是______。
②上述测定实验中,继续滴加Na2S2O3标准溶液至终点的具体实验操作______。
③该样品中的铜含量为______。
【答案】ACD 若温度低,阿司匹林与NaOH中和时不易水解,但反应慢,若温度高,反应快,但部分阿司匹林水解,故反应1中的反应温度要求控制在室温 使反应CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)正向进行,减少碘的吸附,使滴定结果更加准确; 打开旋塞,继续滴加Na2S2O3标准溶液,边加边振荡,眼睛注视锥形瓶中颜色由蓝色恰好变为无色,关闭旋塞,若半分钟不恢复,停止滴加 18.4%
CuSCN(s)+I-(aq)正向进行,减少碘的吸附,使滴定结果更加准确; 打开旋塞,继续滴加Na2S2O3标准溶液,边加边振荡,眼睛注视锥形瓶中颜色由蓝色恰好变为无色,关闭旋塞,若半分钟不恢复,停止滴加 18.4%
【解析】
根据流程:阿司匹林在乙醇的溶解下可以与NaOH发生中和反应1,再加入CuSO4溶液发生反应2得到阿司匹林铜沉淀,抽滤、洗涤干燥得到产品。
(1)A.考虑加快反应速率;
B.用玻璃棒往漏斗里转移溶液;
C.产品不溶于水、醇,洗涤操作中,考虑减少产品的溶解损失;
D.根据阿司匹林铜易受热分解成浅绿色混合物可得;
(2)根据反应速率和阿司匹林的水解分析;
(3)①根据CuI吸附碘,实验测定碘的含量,考虑促进反应CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq);
CuSCN(s)+I-(aq);
②滴定碘,故终点为蓝色褪去,结合滴定操作可得;
③阿司匹林铜溶解得到Cu2+,与KI反应:2Cu2++4I-=2CuI+I2,生成的碘用Na2S2O3标准溶液滴定,根据物质反应转化关系计算可得。
(1)A.反应1中加乙醇作溶剂,可以增大接触面积,加快反应速率,A正确;
B.不能直接用倾析法转移溶液和沉淀,必须用玻璃棒往漏斗里转移溶液和沉淀,B错误;
C.产品不溶于水、醇,洗涤操作中,可先用水洗2-3次,再用酒精洗涤2-3次,酒精挥发易干燥,C正确;
D.已知阿司匹林铜易受热分解成浅绿色混合物,干燥后发现固体呈浅绿色,可能是烘干温度过高造成的结果,D正确;
故合理选项是ACD;
(2)若温度低,阿司匹林与NaOH中和时不易水解,但反应慢,若温度高,反应快,但部分阿司匹林水解,故反应1中的反应温度要求控制在室温;
(3)①实验中加入10mL 10%KSCN试剂,使反应CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)正向进行,减少碘的吸附,使滴定结果更加准确;
CuSCN(s)+I-(aq)正向进行,减少碘的吸附,使滴定结果更加准确;
②继续滴加Na2S2O3标准溶液至终点的具体实验操作为:打开旋塞,继续滴加Na2S2O3标准溶液,边加边振荡,眼睛注视锥形瓶中颜色由蓝色恰好变为无色,关闭旋塞,若半分钟不恢复,停止滴加;
③阿司匹林铜溶解得到Cu2+,与KI反应:2Cu2++4I-=2CuI+I2,生成的碘用Na2S2O3标准溶液滴定,有关系式:2Cu2+~I2~2Na2S2O3,故n(Cu2+)=n(Na2S2O3)=0.1000ml/L×0.023L=0.0023mol,故该样品中的铜含量为![]() ×100%=18.4%。
×100%=18.4%。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
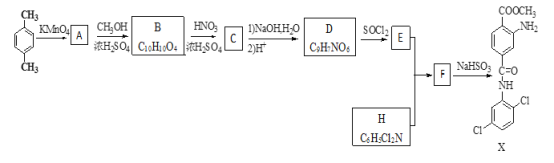
【题目】某研究小组拟合成染料X和医药中间体Y。
已知:①![]() ②
② ③
③![]() ④
④![]() 。
。
(1)下列说法正确的是_________。
A.化合物A能与能与NaHCO3反应产生气体 B.X的分子式是C15H14Cl2O3N2
C.化合物C能发生取代、还原、加成反应 D.A→B,B→C的反应类型均为取代反应
(2)化合物D的结构简式是_________。
(3)写出E+H→F 的化学反应方程式__________________。
(4)写出化合物B(C10H10O4)同时符合下列条件的两种同分异构体的结构简式______________。
①与NaHCO3溶液反应,0.1mol该同分异构体能产生4.48L(标准状况下)CO2气体;②苯环上的一氯代物只有两种且苯环上的取代基不超过三个;③核磁共振氢谱有五种不同化学环境的氢,且峰面积比为1:2:2:2:3。
(5)设计以乙烯为原料合成制备Y(![]() )的合成路线________________(用流程图表示,无机试剂任选)。
)的合成路线________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、M、N,其原子半径与原子序数的关系如图,下列说法错误的是( )

A. 非金属性:X>Z
B. 气态氢化物的稳定性:M<N
C. X和Y形成的化合物只可能含离子键
D. M最高价氧化物对应的水化物是一种弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液
D. 滤液加稀盐酸时只发生反应:H+ +OH- =H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室取用KClO3和MnO2的混合物(共33.2g),加热至恒重,将反应后的固体加30g水充分溶解,剩余固体13.1g(t℃),再加10g水充分溶解,仍剩余固体9.6g(t℃)。
(1)若剩余的9.6g固体全是MnO2,且溶液的体积为VL,则此时c(K+)为______。(结果用含V的最简化代数式表示)
(2)若剩余的9.6g固体是MnO2和KCl的混合物,则混合物中KClO3的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是

A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铁和氧化铁组成的某混合物放入250 mL 2.0 mol·L-1的硝酸溶液中,充分反应后,生成的一氧化氮气体在标准状况下的体积为1.12 L,再向反应后的溶液中加入1.0 mol·L-1的氢氧化钠溶液,要使铁元素完全沉淀下来,加入的氢氧化钠溶液的体积最少是
A.400 mLB.450 mLC.500 mLD.550 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。
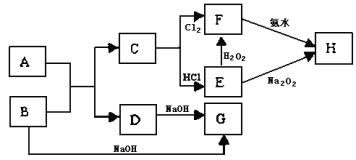
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围____;
(2)写出H2O2的电子式:____;
(3)写出B→G的离子方程式____;
(4)若A、B恰好完全反应,将产物C与足量盐酸反应得到amol气体,另取等质量B与足量盐酸反应得到b mol气体,a:b=5:7,则A的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某种有机物分子的球棍模型图,图中的“棍”代表单键或双键,不同大小的“球”代表不同的短周期元素的原子,对该有机物的叙述不正确的是
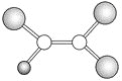
A. 该有机物可能的化学式为C2HCl3
B. 该有机物可以由乙烯和氯化氢通过加成反应得到
C. 该有机物分子中的所有原子在一个平面上
D. 该有机物分子中一定有碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com