
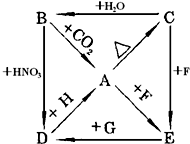
 A、B、C、D、E五种物质都是含二价金属元素X的化合物,它们之间存在下列转化关系,图中H,G,F为另加的试剂.根据以上关系回答:
A、B、C、D、E五种物质都是含二价金属元素X的化合物,它们之间存在下列转化关系,图中H,G,F为另加的试剂.根据以上关系回答:

科目:高中化学 来源: 题型:
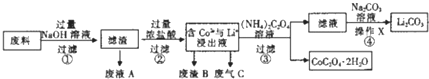
| 编号 | 温度/℃ | 时间/min | 盐酸浓度/mol?L-1 | 钴浸出率/% |
| 1 | 80 | 120 | 3.04 | 97.82 |
| 2 | 80 | 150 | 3.04 | 100.0 |
| 3 | 80 | 180 | 3.04 | 100.0 |
| 4 | 80 | 150 | 2.28 | 100.0 |
| 5 | 80 | 150 | 1.52 | 80.26 |
| 6 | 70 | 150 | 2.28 | 86.85 |
| 7 | 90 | 150 | 2.28 | 100.0 |
| 8 | 80 | 150 | 2.28 | 100.6 |
| 温度/℃ | 0 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 除杂试剂 | 分离方法 | |
| A | 溴苯(溴) | NaOH溶液 | 分液 |
| B | 乙烷(乙烯) | 酸性KMnO4 | 洗气 |
| C | 甲苯(苯酚) | 溴水 | 过滤 |
| D | 溴乙烷(乙醇) | NaOH溶液 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b | B、a=b |
| C、a<b | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| (1) |
| 一定条件 |
| (2) |
| 一定条件 |
| (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M与R的原子序数之差可能等于7 |
| B、若M在第3周期,则R一定在第2周期 |
| C、M2-的离子半径可能比R+的离子半径小 |
| D、两种离子结合形成的化合物可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0的反应是吸热反应 |
| B、△H=ΣH(反应物)-ΣH(生成物) |
| C、所有化学反应的△H都可以通过实验测出 |
| D、△H=反应中化学键形成时吸收的总能量-反应中化学键断裂时放出的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com