
| 催化剂 |
投料比[
| 400K | 500K | 600K | ||
| 1 | 60% | 43% | 28% | ||
| 2 | 45% | 33% | 20% |
| n(NO2) |
| n(CH4) |
 ,
, ;
;| c(N2)c(CO2)c2(H2O) |
| c(CH4)c2(NO2) |
| c(N2)c(CO2)c2(H2O) |
| c(CH4)c2(NO2) |
| ||
| △ |
| 0.008mol |
| 0.014mol+0.008mol+0.006mol+0.012mol |


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
| A、化合反应均为氧化还原反应,有单质生成的化学反应是氧化还原反应 |
| B、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C、溶液是电中性的,胶体是带电的 |
| D、电解质不一定导电,导电的物质不一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
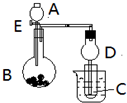 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中:查看答案和解析>>
科目:高中化学 来源: 题型:
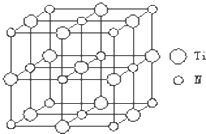 在5-氨基四唑(
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
科目:高中化学 来源: 题型:
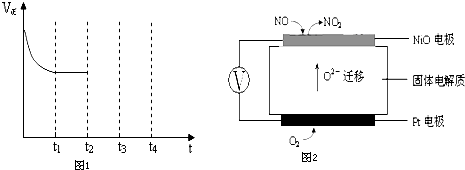
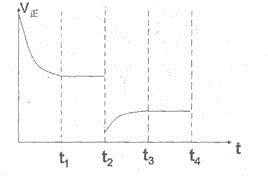
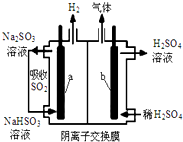 电解法在污染处理上有广泛应用,下面是两例具体应用.
电解法在污染处理上有广泛应用,下面是两例具体应用.查看答案和解析>>
科目:高中化学 来源: 题型:

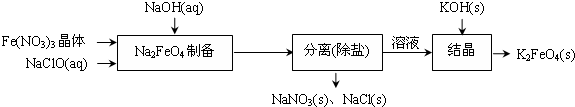
查看答案和解析>>
科目:高中化学 来源: 题型:
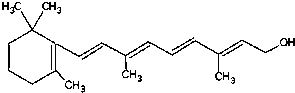
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com