
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
分析 (1)Al2O3、FeO•xFe2O3能与硫酸反应,而SiO2不与硫酸反应,硫酸溶解氧化铝生成硫酸铝和水;
(2)依据氧化还原反应电子守恒和原子守恒,结合元素化合价变化分析产物和反应物,据此书写离子方程式;
(3)铁离子开始沉淀和沉淀完全的溶液pH为1.5~2.8,铝离子开始沉淀pH为3.4,亚铁离子开始沉淀的溶液pH大于铝离子完全沉淀pH,向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;
(4)①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水;
②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去;
(5)从溶液中获得Al2(SO4)3•18H2O晶体,可以通过蒸发浓缩、冷却结晶的方法.
解答 解:(1)Al2O3、FeO•xFe2O3能与硫酸反应,而SiO2不与硫酸反应,步骤Ⅰ过滤得到沉淀的主要成分为:SiO2,硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
故答案为:SiO2;Al2O3+6H+=2Al3++3H2O;
(2)高锰酸根离子在酸溶液中被还原为锰离子,亚铁离子被氧化为铁离子,反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,
故答案为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
(3)铁离子开始沉淀和沉淀完全的溶液pH为1.5~2.8,铝离子开始沉淀pH为3.4,亚铁离子开始沉淀的溶液pH大于铝离子完全沉淀pH,向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离,步骤II的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀,
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
(4)①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水生成的氯气是黄绿色气体,说明沉淀中存在MnO2,
故答案为:生成黄绿色气体;
②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去,
故答案为:除去过量的MnO4-;
(5)从溶液中获得Al2(SO4)3•18H2O晶体,可以通过蒸发浓缩、冷却结晶的方法,
故答案为:蒸发浓缩;冷却结晶.
点评 本题考查实验制备方案,侧重考查学生对原理及操作的分析评价、对数据的分析运用、物质的分离提纯等,需要学生具备知识的基础,难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:实验题
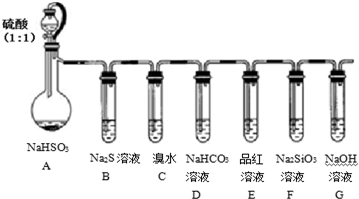
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+H2O?H3O++CH3COO- | B. | CO32-+2H2O?H2CO3+2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | HS-+H2O?H2S+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
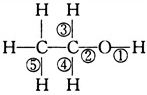 ,关于乙醇在各种不同反应中断键的说法正确的是( )
,关于乙醇在各种不同反应中断键的说法正确的是( )| A. | 和金属钠反应键②断裂 | |
| B. | 在Cu催化下和O2反应键①④断裂 | |
| C. | 和浓硫酸共热140℃时,键①或键②断裂,170℃时键②⑤断裂 | |
| D. | 和氢溴酸反应键①断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C和146C是两种核素 | |
| B. | 纤维素和淀粉互为同分异构体 | |
| C. | CH3COOCH2CH3和CH3CH2OOCCH3是同物质 | |
| D. | CH3CH2COOH可看成是由-C2H5和-COOH两种基团组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
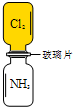 室温下,抽取图两瓶体积相等的氯气和氨气之间的玻璃片后,立即观察到有浓郁白烟,同时一瓶中黄绿色迅速褪去.充分反应后体系中的还原产物是( )
室温下,抽取图两瓶体积相等的氯气和氨气之间的玻璃片后,立即观察到有浓郁白烟,同时一瓶中黄绿色迅速褪去.充分反应后体系中的还原产物是( )| A. | NH4Cl | B. | HCl | C. | N2 | D. | H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com