
| A. | SO2 | B. | BeCl2 | C. | CH3Cl | D. | COCl2 |
分析 同种元素原子间形成的共价键是非极性共价键,不同种元素原子之间形成的共价键是极性共价键;
分子结构不对称,正负电荷的中心不重合的分子为极性分子,而结构对称且正负电荷的中心重合的分子为非极性分子,以此来解答.
解答 解:A.SO2分子中S元素的最外层电子数为6,化合价为+4,最外层电子未全部成键,是极性分子,故A不选;
B.BeCl2分子中Be元素的最外层电子数为2,化合价为+2,最外层电子全部成键,是非极性分子,故B选;
C.CH3Cl分子是四面体正负电荷中心不重合,是极性分子,故C不选;
D.COCl2中心C原子成2个C-Cl键、1个C=O,不含孤电子对,为平面三角形,分子不对称,为极性分子,故D不选;
故选:B.
点评 本题考查共价键和分子极性的判断,注意判断键的极性,抓住共价键的形成是否在同种元素原子之间;分子极性的判断,抓住正负电荷的中心是否重合,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
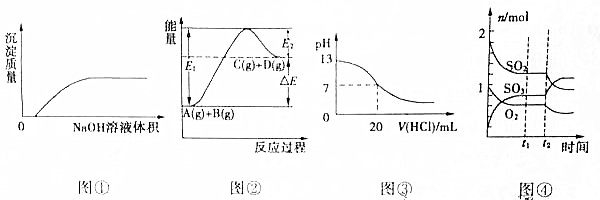
| A. | 图①表示将NaOH溶液滴入Ba(HCO3)2溶液中 | |
| B. | 图②表示反应物的总键能小于生成物的总键能 | |
| C. | 图③表示25℃时,0.1mol/L盐酸滴入20mL0.1mol/LNaOH溶液中,溶液的pH随加入酸体积的变化曲线 | |
| D. | 图④表示一定条件下的反应2SO2(g)+O2?2SO3(g)△H<0,t2时刻改变的曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | |
| B |
| A. | 铍能与冷水发生剧烈反应 | |
| B. | 氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应 | |
| C. | 氢氧化铍的化学式为Be(OH)3 | |
| D. | 氧化铍只溶于强酸溶液,不溶于强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类均有甜味 | B. | 淀粉和纤维素均不是糖类 | ||
| C. | 糖类均不可水解 | D. | 糖类都含有C、H和O元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应剧烈 | |
| B. | 锶在纯净氮气中可以燃烧,燃烧产物投入水中可以放出气体 | |
| C. | 锶在纯氧中点燃可燃烧,燃烧生产的产物投入水中可以放出气体 | |
| D. | 颗粒状的单质锶投入水中,剧烈反应,生成大量的气体并引起气体燃烧和轻微爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
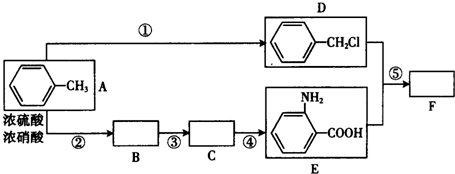
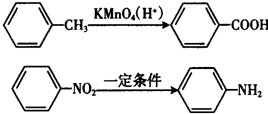
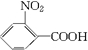 .
. .
.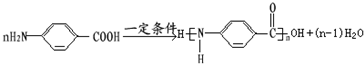 .
.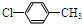 (写结构简式).
(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com