
【题目】下列说法正确的是:( )
① Cl-的结构示意图![]()
② 羟基的电子式:![]()
③ HClO的结构式:H—Cl—O
④ NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤ Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥ SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦ 分馏、干馏、裂化都是化学变化( )
A.①②⑤ B.①④⑥⑦ C.②③④⑥ D.②③⑤⑥⑦
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定的相关问题
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是 (填字母)。
(2)下列操作合理的是 (填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaOH溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用500 mL容量瓶配制1 mol·L-1的氢氧化钠溶液495.5 mL
Ⅱ. 某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是 ___(填编号)。
(2)判断滴定终点的现象是: 。

(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据,请计算待测盐酸的浓度: mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是 (填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别方法不可行的是( )
A.用水鉴别乙醇、甲苯和溴苯
B.用燃烧法鉴别乙醇、苯和四氯化碳
C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的结构式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应),Fe2O3还可用于“铝热法”炼铁,铝热反应在冶金工业上可用于 。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,Na2O的电子式为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O ![]() H+ + OH- ΔH>0 ,下列叙述正确的是( )
H+ + OH- ΔH>0 ,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量冰醋酸,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题已经成为世界上越来越重要的议题,其中大气污染主要有硫的氧化物和氮的氧化物,工业生产是其原因之一,同时工业上通常也用下列方法来治理污染。
(1)烟气中含有SO2等大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
Ⅰ.CaCO3(s)= CO2(g)+CaO(s) △H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)=CaSO3(s) △H=﹣402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)=2[CaSO42H2O](s) △H=﹣234.2kJ/mol
试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式 .
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气体3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)氨催化氧化是硝酸工业的基础,反应原理为:4NH3(g)+5O2(g)4NO(g)+6H2O(g)实际生产中,还会发生此反应:4NH3+3O2N2+6H2O,在1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中,有关温度与各物质的量关系如图1所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x= 。
②NH3生成N2的反应属于 (填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是 。
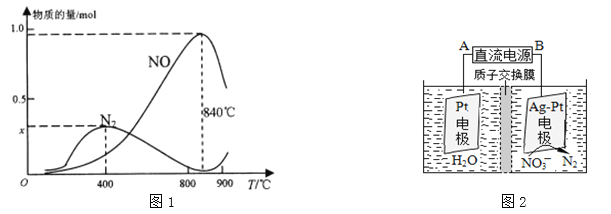
(4)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO![]() 的原理如图2所示,阴极反应式为 。假设降解前两极溶液质量相等,当电路中有2mol电子通过时,此时两极溶液质量的差值为 g。
的原理如图2所示,阴极反应式为 。假设降解前两极溶液质量相等,当电路中有2mol电子通过时,此时两极溶液质量的差值为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
则CH4(g)将NO2(g)还原为N2(g)的热化学方程式是 。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。
2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。
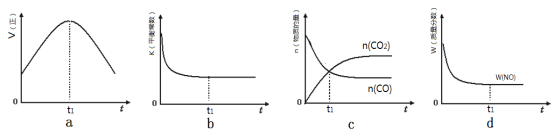
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。ΔH<0
2CO2(g)+N2(g)。ΔH<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(4)利用ClO2氧化氮氧化物反应过程如下:![]()
反应Ⅰ的化学方程式是2NO+ClO2+H2O===NO2+HNO3+2HCl,反应Ⅱ的化学方程式是。若有11.2LN2生成(标准状况),共消耗ClO2 g。
(5)工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4然后采用电解法制备N2O5,装置如下图所示。Pt甲为的电极反应式是 。
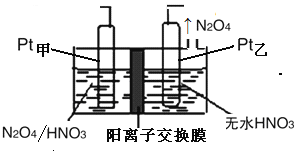
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com