


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源:2012-2013学年河南省安阳一中高一下学期第二次阶段测试化学试卷(带解析) 题型:填空题
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要吸收能量,形成化学键要放出能量。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘单质反应(H2+I2=2HI)生成1 mol HI需要 (填“放出”或“吸收”) ___ kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
在如图甲装置中,负极电极反应式为 ,发生的是 反应(填“氧化”或“还原”,下同)。正极电极反应式为 ;总反应的离子方程式为 。
(3)若用氢氧化钾溶液做电解质溶液,用氢气做燃料,空气做氧化剂制成燃料电池,其负极反应式为 ;正极反应式为 。当有标状下2.24L氢气消耗时,另一极消耗氧气的物质的量为 。
(4)在如下图所示的原电池中,铝做 极,导线上电子由 极流向 极。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高一下学期期末考试化学试卷(解析版) 题型:填空题
(13分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。已知拆开1 mol H-H键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
如右图装置,烧杯中盛有饱和食盐水,X、Y是两块石墨电极,两电极通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液,请回答以下问题:
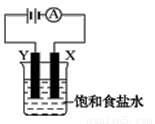
①该装置最主要的能量转化为_________________
②在X电极附近溶液中可观察到的现象是 X电极上发生_______反应(填“氧化”或“还原”),电极反应式为_____________________。
③检验Y电极上产物的方法是 。
④装置的总反应化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏南通小海中学高一下学期期中考试化学试卷(解析版) 题型:填空题
(13分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。
(2)在生产和生活中经常遇到化学能与电能的相互转化。

如图甲是将 能转化为 能的装置,负极电极反应式为 ,发生______反应(填“氧化”或“还原”,下同)。正极现象 ,发生______反应;发生反应时,电子由_____片流向_____片。当导线中有2 mol电子通过时,正极上析出 g 氢气。
查看答案和解析>>
科目:高中化学 来源:09-10年大连长海高中高一下学期期末考试化学卷 题型:填空题
(12分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 _ ,形成化学键要 。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 __ (填“放出”或“吸收”) ___ kJ的热量。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。已知8g甲烷完全燃烧生成液态水时放出445.0kJ的热量,请写出甲烷燃烧热的热化学方程式____________________________________。

(3)在生产和生活中经常遇到化学能与电能的相互转化。
在如图甲、乙两装置中,甲中负极电极反应式为_____________________,
溶液中的阳离子向_____极移动(填“正”或“负”);乙中铝电极作__________极,发生______反应(填“氧化”或“还原”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com