

 ��
�� ����һ��ͬ���칹��Ľṹ��ʽ
����һ��ͬ���칹��Ľṹ��ʽ ��
��
 $��_{CH_{3}OH}^{H_{2}/Pd}$
$��_{CH_{3}OH}^{H_{2}/Pd}$ ����CH3OH ��
����CH3OH ��  Ϊԭ���Ʊ�
Ϊԭ���Ʊ�  ��д���Ʊ��ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
��д���Ʊ��ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ��� ���� ��1����ϳ��������ŵĽṹ�ж�H�����еĺ��������ţ�
��2������B��C�Ľṹ��ʽ�������ԭ���غ��ƶϻ�����X�Ľṹ��ʽ��
��3����D��E�ķ�Ӧ���������������������Ӧ���Ƚ�E��F�Ľṹ��ʽ�����ж�E��F�ķ�Ӧ���ͣ�
��4�����ܷ���������Ӧ��˵�����ӽṹ�к���ȩ�������������˴Ź���������ʾ����3�ֲ�ͬ��ѧ��������ԭ�ӣ�˵�����ӽṹ�Գ��Խ�ǿ���ɾݴ�д������������B��ͬ���칹�壻
��5����CH3OH ��  Ϊԭ���Ʊ�
Ϊԭ���Ʊ�  �������ü״���Na�������ɼ״��ƣ�����
�������ü״���Na�������ɼ״��ƣ����� ����ȡ����Ӧ�������������ӳɺ����������������ɵõ�Ŀ����
����ȡ����Ӧ�������������ӳɺ����������������ɵõ�Ŀ����
��� �⣺��1������H�Ľṹ��ʽ��H�к������������Ѽ������ǻ����ʴ�Ϊ���Ѽ������ǻ���
��2������X�ķ���ʽ���Լ�B��C�ṹ��ʽ�ĶԱȣ��Ƴ��Լ�X�Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ��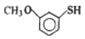 ��
��
��3���Ա�D��E�Ľṹ��ʽ��D��S����һ������˫����D����E�˷�Ӧ��������Ӧ���Ա�E��F�ṹ��ʽ��E��F����ȡ����Ӧ���ʴ�Ϊ��������Ӧ��ȡ����Ӧ��
��4���ܷ���������Ӧ��˵������ȩ�������������˴Ź���������ʾ��3�ֲ�ͬ��ѧ��������ԭ�ӣ�˵���ǶԳƽṹ������������4��ȡ��������λ�ڶԳƽṹ���ṹ��ʽΪ�� ��
�� ��
��
�ʴ�Ϊ�� ��
�� ��
��
��5��-Brת����-OCH3�����Ը���G����H�����CH3OHת����CH3ONa������ ��Ӧ��-OCH3ȡ�����λ�ã�������Ϣ�������ʻ���Ȼ�����������������ǻ��������Ȼ������ϳ�·����
��Ӧ��-OCH3ȡ�����λ�ã�������Ϣ�������ʻ���Ȼ�����������������ǻ��������Ȼ������ϳ�·����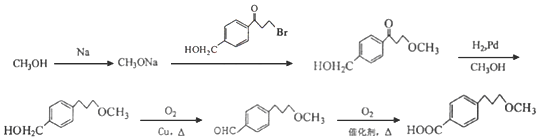 ��
��
�ʴ�Ϊ��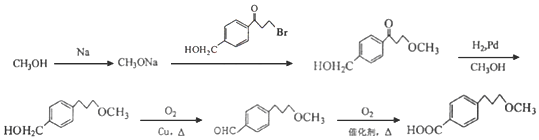 ��
��
���� ���⿼���л��ƶ���ϳɣ��漰�����ŵ��ж����������л���Ӧ���͵��жϼ�������ͬ���칹�����д�ȣ��ѵ�Ϊ����ԭ����ƺϳ�·�ߺϳ�Ŀ�����ۺ��Խ�ǿ���ѶȽϴ�ѧ������Ҫ��ϸߣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
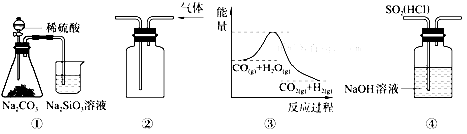
| A�� | ͼ����ʾʵ��ɱȽ���̼��������Ԫ�صķǽ�����ǿ�� | |
| B�� | ��ͼ����ʾʵ��װ���ſ������ռ�CO2���� | |
| C�� | ͼ�۱�ʾ���淴ӦCO��g��+H 2O ��g��?CO2��g��+H2��g�� �����ȷ�Ӧ | |
| D�� | ͼ��װ�ÿ���������ȥSO2�е�HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ѧ�ڻ�������������ʮ����Ҫ�����ã��绯ѧ����NO3-��ԭ����ͼ��ʾ������˵������ȷ���� �����ԭ������ O-16����������
��ѧ�ڻ�������������ʮ����Ҫ�����ã��绯ѧ����NO3-��ԭ����ͼ��ʾ������˵������ȷ���� �����ԭ������ O-16����������| A�� | AΪ��Դ������ | |
| B�� | ��Һ��H+������������Ǩ�� | |
| C�� | Ag-Pt�缫�ĵ缫��ӦʽΪ2NO3-+12H++10e-�TN2��+6H2O | |
| D�� | �������У�ÿת��2 mol���ӣ������缫�Ͳ���32gO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �������Һ�絼��Խ������Խǿ����������0.100mol•L-1����ֱ�ζ�10.00mLŨ�Ⱦ�Ϊ0.100mol•L-1��NaOH��Һ�Ͷ��װ�[��CH3��2NH]��Һ�����װ���ˮ�е����뵪���ƣ�����Kb[��CH3��2NH]=1.6��10-4�����ô�������õζ���������Һ�ĵ絼����ͼ��ʾ������˵����ȷ���ǣ�������
�������Һ�絼��Խ������Խǿ����������0.100mol•L-1����ֱ�ζ�10.00mLŨ�Ⱦ�Ϊ0.100mol•L-1��NaOH��Һ�Ͷ��װ�[��CH3��2NH]��Һ�����װ���ˮ�е����뵪���ƣ�����Kb[��CH3��2NH]=1.6��10-4�����ô�������õζ���������Һ�ĵ絼����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ���ߢڴ����ζ����װ���Һ������ | |
| B�� | A����Һ�У�c��H+��=c��OH-��+c[��CH3��2NH•H2O] | |
| C�� | D����Һ�У�2c��Na+��=3c��Cl-�� | |
| D�� | ����ͬ�¶��£�A��B��C��D�ĵ����Һ�У�ˮ�ĵ���̶�������C�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��AG��ʾ��Һ����ȣ�AG=lg$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$��298Kʱ��c��OH-����10.0mL 0.1mol•L-1��ˮ�е���0.05mol•L-1������Һ����Һ�����������������Һ�������ϵ��ͼ��ʾ�������й�������ȷ���ǣ�������
��AG��ʾ��Һ����ȣ�AG=lg$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$��298Kʱ��c��OH-����10.0mL 0.1mol•L-1��ˮ�е���0.05mol•L-1������Һ����Һ�����������������Һ�������ϵ��ͼ��ʾ�������й�������ȷ���ǣ�������| A�� | 0.1 mol•L-1��ˮ�ĵ����ԼΪ1.0% | |
| B�� | �ζ�����Ӧ��ѡ���̪��Ϊָʾ�� | |
| C�� | N����Һ�У�c��SO42-����c��NH4+����c��H+����c��OH-�� | |
| D�� | �ζ������д�M�㵽N����Һ��ˮ�ĵ���̶���������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ�������1mol�Ҵ���1.2mol�����ַ�Ӧ������NA�������������� | |
| B�� | 0.1mol•L-1 HCOOH ����õ�NA��H+ | |
| C�� | ��ȩ��������������Һ��Ӧ��һ������2NA�����ۼ� | |
| D�� | ͭ������1mol 2-����ȫ��ת��Ϊ��ͪ��ʧȥ2NA ��e- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com