
| A. | Na+<Mg2+<K+<O2- | B. | Na+>Mg2+>S2->Cl- | ||
| C. | Na>Mg>Al>S | D. | Cs<Rb<K<Na |
分析 粒子的电子层越多,粒子的半径越大;电子层相同时,粒子的核电荷数越大,粒子的半径越小,据此结合元素周期律知识进行解答.
解答 解:A.K+的电子层最多,其离子半径最大;Na+、Mg2+、O2-具有相同的电子层结构,核电荷数越大,微粒半径越小,则微粒半径大小为:Mg2+<Na+<O2-<K+,故A错误;
B.S2-和Cl-具有相同的电子层结构,核电荷数越大,微粒半径越小,即微粒半径由大到小的顺序是:r(S2-)>r(Cl-),同理r(Na+)>r(Mg2+),但Cl-比Na+多一个电子层,显然r(Cl-)>r(Na+),所以离子半径大小是:S2->Cl->Na+>Mg2+,故B错误;
C.Na、Mg、Al、S的电子层数相同,核电荷数越大,原子半径越小,则原子半径大小为:Na>Mg>Al>S,故C正确;
D.Cs、Rb、K、Na位于同一主族,电子层越大,原子半径越大,则原子半径大小为:Cs>Rb>K>Na,故D错误,
故选C.
点评 本题考查微粒半径大小比较,为高频考点,侧重于元素周期律的综合考查与运用,难度中等,明确微粒半径大小比较的规律为解答关键,试题培养了学生的分析能力及灵活应用能力.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去NaCl中少量的KNO3,可将固体混合物制成热饱和溶液,冷却结晶、过滤 | |
| B. | 探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生浑浊的快慢,来反映试剂反应速率的大小.从而探究浓度,温度等外界条件对该反应的化学反应速率的影响 | |
| C. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| D. | 为了加快反应速率得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径 (×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
主要化合价 | 最高 正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低 负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | H2Q的还原性和稳定性大于RH3 | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM,YM都是电解质,熔融状态下都能电解 | |
| D. | 元素Z、M组成的化合物熔化时破坏了离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与氯气反应 | B. | CO通过灼热的三氧化二铁 | ||
| C. | 向氯化亚铁溶液中滴加双氧水 | D. | 铁与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
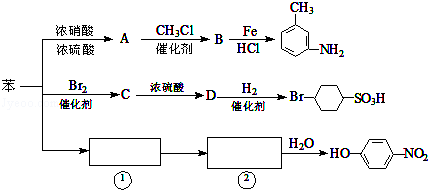
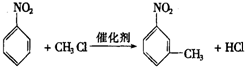 .
.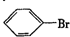 ,②
,②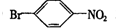 .
.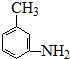 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钙溶液和氢氧化钠 | B. | 碳酸钠溶液和硫酸 | ||
| C. | 偏铝酸钠溶液和氢氧化钠 | D. | 硫酸氢钠溶液和氯化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “硅胶”常用作袋装食品的干燥剂 | |
| B. | 氢氧化铝具有弱碱性,常用作胃酸中和剂 | |
| C. | 碳纤维,是一种新型无机非金属材料 | |
| D. | 工业上以氯气和澄清石灰水为原料制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它位于周期表的第四周期第ⅠA族 | B. | 硝酸铷是离子化合物 | ||
| C. | 氢氧化铷是弱碱 | D. | 在钠、钾、铷3种元素中铷熔点最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com