
����Ŀ����ѧ��ѧ���кܶ����ʿ���ʵ��ͼ������֮���ת�������з�Ӧ�����Ͳ��ַ�Ӧ�IJ�������ȥ��Һ��B��C�����ǵ�һ���ʵ���Һ��Ҳ�����Ǵ����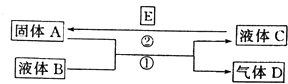
��1����A��һ���Ϻ�ɫ����������D��ʹƷ����Һ��ɫ������ʱ�ָֻ�ԭɫ��д����Ӧ�ٵĻ�ѧ����ʽ�� ��
������D����һ������H��Ϻ�����һ�ֵ���ɫ����W��д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2����A��һ�ֽ������ʣ�D���ܶ���С�����壬B�ܷ���ˮ����A�����ܡ���B��������
��3����A�ǽ������ʣ�D��һ����ɫ���壬����������Ϊ����ɫ��Һ��C����ɫ��д����Ӧ�ٵ����ӷ���ʽ�� �� д����Ӧ�ڵ�����һ�����ӷ���ʽ�� ��
���𰸡�
��1��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��2H2S+SO2=3S+2H2O
CuSO4+SO2��+2H2O��2H2S+SO2=3S+2H2O
��2��B����
��3��3Cu+8H++2NO3���T3Cu2++2NO��+4H2O��Cu2++Fe=Fe2++Cu
���������⣺��1����A��һ���Ϻ�ɫ������ӦΪͭ������D��ʹƷ����Һ��ɫ������ʱ�ָֻ�ԭɫ��ӦΪSO2 �� A��B�ķ�ӦΪͭ��Ũ�����ڼ��������µķ�Ӧ����Ӧ�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��SO2����һ������H��Ϻ�����һ�ֵ���ɫ����w��HӦΪH2S��wΪS���ʣ��÷�Ӧ�ķ���ʽΪ2H2S+SO2=3S+2H2O�����Դ��ǣ�Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O��SO2����һ������H��Ϻ�����һ�ֵ���ɫ����w��HӦΪH2S��wΪS���ʣ��÷�Ӧ�ķ���ʽΪ2H2S+SO2=3S+2H2O�����Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��2H2S+SO2=3S+2H2O����2����A��һ�ֽ������ʣ�D���ܶ���С�����弴���������B��ˮ��˵��A�Ƿdz����õĽ�������Na��CΪNaOH������һ������Na������B������ˮ��D��һ����ɫ���壬ӦΪH2 �� ��BΪNaOH��Һ����CΪNaAlO2 �� ���ܷ����û���Ӧ����Al�����Դ��ǣ�B����3��D��һ����ɫ���壬����������Ϊ����ɫ��ӦΪNO��Һ��C����ɫ��˵��AΪCu��BΪϡ���ᣬCΪCu��N03��2 �� ��Ӧ�ٵ����ӷ���ʽΪ3Cu+8H++2NO3���T3Cu2++2NO��+4H2O����Ӧ��Ϊ�û���Ӧ������Cu�����ӷ���ʽ��дΪCu2++Fe=Fe2++Cu�ȣ����Դ��ǣ�3Cu+8H++2NO3���T3Cu2++2NO��+4H2O��Cu2++Fe=Fe2++Cu��
CuSO4+SO2��+2H2O��2H2S+SO2=3S+2H2O����2����A��һ�ֽ������ʣ�D���ܶ���С�����弴���������B��ˮ��˵��A�Ƿdz����õĽ�������Na��CΪNaOH������һ������Na������B������ˮ��D��һ����ɫ���壬ӦΪH2 �� ��BΪNaOH��Һ����CΪNaAlO2 �� ���ܷ����û���Ӧ����Al�����Դ��ǣ�B����3��D��һ����ɫ���壬����������Ϊ����ɫ��ӦΪNO��Һ��C����ɫ��˵��AΪCu��BΪϡ���ᣬCΪCu��N03��2 �� ��Ӧ�ٵ����ӷ���ʽΪ3Cu+8H++2NO3���T3Cu2++2NO��+4H2O����Ӧ��Ϊ�û���Ӧ������Cu�����ӷ���ʽ��дΪCu2++Fe=Fe2++Cu�ȣ����Դ��ǣ�3Cu+8H++2NO3���T3Cu2++2NO��+4H2O��Cu2++Fe=Fe2++Cu��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��IUPAC����117��Ԫ��ΪTs(��������![]() ��,ti��n),Ts��ԭ�Ӻ���������������7������˵������ȷ���ǣ� ��
��,ti��n),Ts��ԭ�Ӻ���������������7������˵������ȷ���ǣ� ��
A. Ts�ǵ������ڵڢ�A��Ԫ�� B. Ts��ͬλ��ԭ�Ӿ�����ͬ�ĵ�����
C. Ts��ͬ��Ԫ���зǽ��������� D. HTs������ˮ���ȶ���ǿ����ԭ��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��Ƽ��仯��������Ҫ���塣
��1��ʵ��������0.1molL-1��̼������Һ480mL������������Һ�Ĺ��̣��ش����⣺
��ʵ���г���Ҫ������ƽ�������룩��ҩ�ס��ձ��Ͳ������⣬����Ҫ����������������_________��
��ʵ��������������ƽ�������룩����̼���ƹ���_______________g��
��ijͬѧ���� Na2CO3��Һ�Ĺ�����ͼ��ʾ������Ϊ��ͬѧ�Ĵ�����___________��
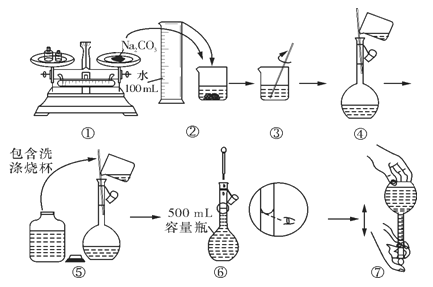
A���٢� B���ڢܢ� C���٢ݢ� D���ݢޢ�
������ʵ�������ʹ��õ���ҺŨ��ƫС����___________��
A��ת����Һ��δϴ���ձ��Ͳ�������ֱ�Ӷ���
B������ƿʹ��ǰû�о������ƿ����������ˮ
C��������ƿ�ж���ʱ���ӿ̶���
D�����ݺ������ƿ��תҡ�ȣ�����Һ����ڿ̶ȣ��ٲ��伸��ˮ���̶�
��2���������Ʊ��治�����ױ�������Na2CO3��ij����������Ʒ�Ѿ����ֱ��ʣ��������ʵ�飬����һ����Һ��ˮ��֤�����������Ѿ����ֱ��ʣ�_________________��˵������������ͽ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.92g CuƬ��һ������ŨHNO3���ã����ռ���NO2��NO���干1.12Lʱ����״����������ͭǡ��ȫ�����ã���
��1����Ӧ������HNO3mol��ת�Ƶ���mol��
��2������ˮ���ռ����ɵ����壬�����������ΪL����״������
��3�����ռ�����������ͨ��mL O2����״��������ʹˮ�պó�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ�����е��������ۣ�����ѡȡ����������Һ
A. Ũ���� B. ϡ���� C. ϡ���� D. Ũ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ã�������ָ�뷢��ƫת��ͬʱA����֣�B����ϸ��CΪ�������Һ����A��B��C���������и����е�
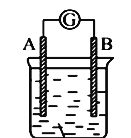
A. A��Ag��B��Fe��CΪϡAgNO3��Һ
B. A��Cu��B��Zn��CΪϡH2SO4
C. A��Fe��B��Ag��CΪϡAgNO3��Һ
D. A��Zn��B��Cu��CΪϡH2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪2H��H2�ų�437.6 kJ������������˵����ȷ����_______
A. ����������ÿ����ԭ�Ӷ��ﵽ�ȶ��ṹ
B. �������ӵ�������������ԭ�ӵ�������
C. 1 mol H2 ���� 2 mol H Ҫ�ų�437.6 kJ����
D. ��ԭ�ӱ����������ȶ�
��2����֪ԭ��ص��ܷ�Ӧʽ��Cu + 2FeCl3 = CuCl2 + 2FeCl2����д���缫��Ӧ����ʽ��
����___________________________________
����___________________________________
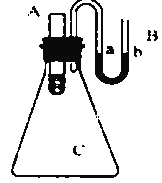
��3����ͼ��ʾ������ƿ����װ��ˮ��С�Թܣ���С�Թ��зֱ�����������ʣ����ռ���� ��Ũ���� ������粒����NaCl���壬������ʹa��Һ�����b��Һ�����_______________��������ţ�
��4����ѧ��������Ƴ�����̫���ܲ������⣬���ڶ������ѣ�TiO2����������ʹ��ˮ�ֽ�õ��������¼���2H2O![]() 2H2��+O2�����Ƶõ���������������ȼ�ϵ�أ��Իش��������⣺
2H2��+O2�����Ƶõ���������������ȼ�ϵ�أ��Իش��������⣺
�ٷֽ⺣ˮʱ��ʵ���˹���ת��Ϊ______�ܣ����ɵ�������������ȼ�ϵ��ʱ��ʵ���˻�ѧ��ת��Ϊ______�ܣ��ֽ⺣ˮ�ķ�Ӧ����______��Ӧ��������������������������
��ij������ȼ�ϵ�����ù�������������մ�������ʣ�A���Ϸ����ĵ缫��ӦΪ��2H2 + 2O24e=2H2O����A���ǵ�ص�______�������ӴӸü�______��������������������������B���ĵ缫��ӦʽΪ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£���2L�ܱ������м���1mol NO��1mol����̿��������Ӧ��
2NO(g)+C(s) ![]() N2(g)+CO2(g) ��H=-213.5kJ/mol���ﵽƽ��ʱ���������£�
N2(g)+CO2(g) ��H=-213.5kJ/mol���ﵽƽ��ʱ���������£�
�¶�/�� | n(����̿)/mol | n(CO2)/mol |
T1 | X | |
T2 | 0.25 |
����˵������ȷ���ǣ� ��
A. T2��ʱ�����÷�Ӧ����10min�ﵽƽ�⣬��Ӧ����v(NO)=0.025mol/(L��min)
B. T1��ʱ�����÷�Ӧ��ƽ�ⳣ��K=9/16�����ƽ��ʱNO��ת����Ϊ60%
C. T2��ʱ������Ӧ��ƽ�������С�����������c(N2):c(NO)����
D. T1��ʱ������ʼʱ��Ӧ�������������һ�룬ƽ���NO��ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н���Ԫ�صĵ��ʻ����ڻ���������ʱ������ɫ�ܲ�����ɫΪ��ɫ���ǣ� ��
A.��B.��C.þD.��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com