
【题目】短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子层结构,X的族序数等于周期数,Y与Z最外层电子数之和为10。下列说法不正确的是
A. X的最高价氧化物的水化物能溶解在Z的最高价氧化物的水化物溶液中
B. W、X、Z的简单离子均能促进水的电离
C. W的氢化物与X、Y、Z的氧化物均不反应
D. 原子半径:X>Y>Z>W
【答案】C
【解析】短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子层结构,则W为F;X的族序数等于周期数,则X为![]() ,Y与Z最外层电子数之和为10,且应为第三周期元素,则Y为Si,Z为S 。综上,W、X、Y、Z分别为F、Al、Si、S;X的最高价氧化物的水化物为Al(OH)3,Z的最高价氧化物的水化物为H2SO4,二者可以发生反应,A正确;W、Z的离子为弱酸对应的阴离子F-、S2-;X的离子为弱碱对应的阳离子Al3+,均可发生水解反应,均能促进水的电离,B正确;W的氢化物和Y的氧化物分别为HF和SiO2,两者可以发生反应,C错误;根据同周期原子半径逐渐减小,且电子层数越多,原子半径越大,可以得出四种元素的原子半径的大小关系为:X>Y>Z>W,D正确;正确选项C。
,Y与Z最外层电子数之和为10,且应为第三周期元素,则Y为Si,Z为S 。综上,W、X、Y、Z分别为F、Al、Si、S;X的最高价氧化物的水化物为Al(OH)3,Z的最高价氧化物的水化物为H2SO4,二者可以发生反应,A正确;W、Z的离子为弱酸对应的阴离子F-、S2-;X的离子为弱碱对应的阳离子Al3+,均可发生水解反应,均能促进水的电离,B正确;W的氢化物和Y的氧化物分别为HF和SiO2,两者可以发生反应,C错误;根据同周期原子半径逐渐减小,且电子层数越多,原子半径越大,可以得出四种元素的原子半径的大小关系为:X>Y>Z>W,D正确;正确选项C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列化学反应既不属于氧化还原反应又不属于四种基本反应类型的是
A. Cl2+2KBr=Br2+2KCl B. 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C. 3O2=2O3 D. 2CO+O2![]() 2CO2
2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
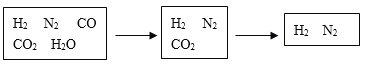
(1)步骤ⅰ,发生的是CO变换反应。
①CO变换反应的化学方程式是____________________________________。
②一定条件下,向体积固定为1 L的密闭容器中充入一定量半水煤气,发生CO变换反应。下图表示氢气与氮气的平衡体积比[V(H2):V(N2)]随外部条件X的变化关系。
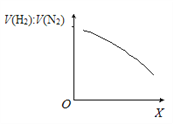
Ⅰ.X代表的物理量是______________________________。
Ⅱ.CO变换反应的△H _____0(填“>”或“<”),判断的依据是_____________________________。
③若用a、b、c、d 分别代表CO变换反应中相关化学键:H-H、H-O、![]() 、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是
、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是![]() 。消耗1mol CO时,该反应的热效应 △H = _______________。
。消耗1mol CO时,该反应的热效应 △H = _______________。
(2)步骤ⅱ中,用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2。
①当溶液pH降至10的过程中(无沉淀析出),溶液中离子浓度关系正确的是________(选填字母)。
a.c(CO32-)+c(HCO3-) + c(H2CO3) =2.0 mol/L
b.c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
c.c(Na+)>c(CO32-)>c(HCO3-)
②当脱除液失效时,请设计一种可使其再生的方法(结合化学方程式说明):___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
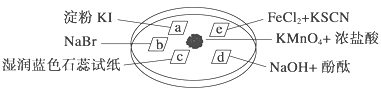
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(g)+nB(g)pC(g)+qD(g)+Q (Q>0),且m+n>p+q,使平衡向正反应方向移动的条件是( )
A.降温、降压B.升温、降压C.降温、增压D.升温、增压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,在工业上有着广泛而重要的用途。
(1)基态钛原子的价电子排布图为__________________;基态铝原子核外电子分布在____个能级上。
(2)许多金属及其化合物灼烧时会产生特征焰色,产生焰色的原因是______________________。
(3)FeCl3熔点306℃、沸点315℃,CaCl2熔点782℃、沸点1600℃,同是金属氯化物,熔沸点差别很大的原因是________________________________。
(4)煅烧铁矿石常会生成SO2,SO2为_______分子(填“极性”或“非极性”);分子中的大π键可用符号Пnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为П66)。推测SO2分子中的大π键可表示为_______________。
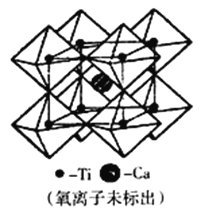
(5)钙钛矿可用来冶炼钛,它的晶胞结构如图所示。钛离子位于立方晶胞的角顶,被____个氧离子包围成配位八面体;钙离子离子位于立方晶胞的体心,被_____个氧离子包围。钙钛矿晶体的化学式为________________________。若该晶胞的边长为apm,则钙钛矿晶体的密度为_____________g·cm-3(用NA表示阿保加德罗常数的值,只要求列算式,不必计算出数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标况)氢气,原混合物的质量可能是( )
A. 2 g B. 1 g C. 8 g D. 10 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com