
ЁОЬтФПЁПЯТСаЙигкбЮРрЫЎНтЕФЫЕЗЈДэЮѓЕФЪЧ(ЁЁЁЁ)
A.pHЯрЕШЕФЂйNaHCO3ЁЂЂкNa2CO3ЁЂЂлNaOHШмвКЕФЮяжЪЕФСПХЈЖШДѓаЁЃКЂйЃОЂкЃОЂл
B.ХЈЖШОљЮЊ0.1 molЁЄLЃ1ЕФЂй(NH4)2CO3ЁЂЂк(NH4)2SO4ЁЂЂл(NH4)2Fe(SO4)2ШмвКжаЃЌc(NH4+)ЕФДѓаЁЫГађЮЊЂйЃОЂкЃОЂл
C.дкNH4ClШмвКжаМгШыЯЁHNO3ЃЌФмвжжЦNH4+ЫЎНт
D.дкCH3COONaШмвКжаМгШыБљДзЫсЃЌФмвжжЦCH3COOЃЫЎНт
ЁОД№АИЁПB
ЁОНтЮіЁП
AЃЎpHЯрЕШЕФЂйNaHCO3ЁЂЂкNa2CO3ЁЂЂлNaOHЃЌШмвКМюаддНЧПашвЊШмвКХЈЖШдНаЁЃЌШмвКЕФЮяжЪЕФСПХЈЖШДѓаЁЃКЂйЃОЂкЃОЂлЃЌЙЪAе§ШЗЃЛ
BЃЎ(NH4)2CO3 жаCO32-ДйНјNH4+ЫЎНтЃЌ(NH4)2Fe(SO4)2жаFe2+вжжЦNH4+ЫЎНтЃЌвђДЫЯрЭЌХЈЖШЕФетМИжжШмвКжаяЇИљРызгХЈЖШДѓаЁЫГађЪЧЂлЃОЂкЃОЂйЃЌЙЪBДэЮѓЃЛ
CЃЎдкNH4ClШмвКжаяЇИљРызгЫЎНтШмвКЯдЫсадЃЌNH4++H2O=NH3H2O+H+ЃЌМгШыЯЁHNO3ЃЌЧтРызгХЈЖШдіДѓЃЌЦНКтФцЯђвЦЖЏЃЌвжжЦNH4+ЫЎНтЃЌЙЪCе§ШЗЃЛ
DЃЎДзЫсФЦШмвКжаЃЌДзЫсИљРызгЫЎНтЃЌCH3COO-+H2O![]() CH3COOH+OH-ЃЌШмвКЯдМюадЃЌМгШыБљДзЫсЃЌДзЫсХЈЖШдіДѓЃЌЫЎНтЦНКтФцЯђвЦЖЏЃЌвжжЦCH3COO-ЫЎНтЃЌЙЪDе§ШЗЃЛ
CH3COOH+OH-ЃЌШмвКЯдМюадЃЌМгШыБљДзЫсЃЌДзЫсХЈЖШдіДѓЃЌЫЎНтЦНКтФцЯђвЦЖЏЃЌвжжЦCH3COO-ЫЎНтЃЌЙЪDе§ШЗЃЛ
ЙЪбЁBЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.114КХдЊЫидкжмЦкБэжаЕкЦпжмЦкЕкVIAзхЃЌЪєгкН№ЪєдЊЫи
B.ОЇЬхЙшШлЕуИпгВЖШДѓЃЌПЩгУгкжЦзїЙтЕМЯЫЮЌ
C.ЮЊСЫГ§ШЅMgCl2ЫсадШмвКжаЕФFe3+ЖјЕУЕННЯДПОЛЕФMgCl2ШмвКЃЌПЩдкМгШШНСАшЕФЬѕМўЯТМгШыMgCO3ЃЌЙ§ТЫКѓЃЌдйЯђТЫвКжаМгШыЪЪСПЕФбЮЫс
D.ЙтЪјЭЈЙ§ЯТСаЗжЩЂЯЕЂйгаГОАЃЕФПеЦјЂкУїЗЏШмвКЂлФЋЫЎЂмЯЁЖЙНЌЪБЃЌЖМФмВњЩњЖЁДяЖћаЇгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
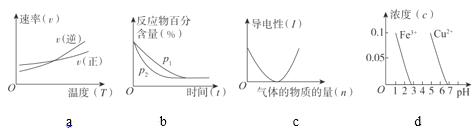
ЁОЬтФПЁПЯТСаЭМЪОгыЖдгІЕФа№ЪіЯрЗћЕФЪЧ![]()
A. ЭМЫљЪОЕФЗДгІЃЌШєЩ§ИпЮТЖШЃЌИУЗДгІЕФЦНКтГЃЪ§БфаЁ
ЭМЫљЪОЕФЗДгІЃЌШєЩ§ИпЮТЖШЃЌИУЗДгІЕФЦНКтГЃЪ§БфаЁ
B.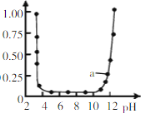 ЭМЫљЪОЕФЪЧ
ЭМЫљЪОЕФЪЧ![]() гы
гы![]() ЗДгІЪБКЌТСЮЂСЃХЈЖШБфЛЏЧњЯпЃЌЭМжаaЕуШмвКжаДѓСПДцдк
ЗДгІЪБКЌТСЮЂСЃХЈЖШБфЛЏЧњЯпЃЌЭМжаaЕуШмвКжаДѓСПДцдк![]()
C. БэЪОЕШpHЕФбЮЫсгыДзЫсжаЗжБ№МгЫЎЯЁЪЭЕФpHБфЛЏЃЌЦфжаЧњЯпbЖдгІЕФЪЧбЮЫс
БэЪОЕШpHЕФбЮЫсгыДзЫсжаЗжБ№МгЫЎЯЁЪЭЕФpHБфЛЏЃЌЦфжаЧњЯпbЖдгІЕФЪЧбЮЫс
D. БэЪОЯђ
БэЪОЯђ![]() ШмвКжаж№ЕЮМгЯЁбЮЫсЃЌЩњГЩ
ШмвКжаж№ЕЮМгЯЁбЮЫсЃЌЩњГЩ![]() гыЫљМзбЮЫсЮяжЪЕФСПЕФЙиЯЕ
гыЫљМзбЮЫсЮяжЪЕФСПЕФЙиЯЕ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПХаЖЯе§ЮѓЃЈдкД№ЬтПЈБэИёжаЂй~ЬтЬтКХЖдгІЮЛжУЛЁАЁЬЁБЛђЁАЁСЁБЃЉЁЃ
ЃЈ1ЃЉ2020Фъ6дТ23Ше9ЪБ43ЗжББЖЗЯЕЭГЕкЮхЪЎЮхПХЕМКНЮРаЧєпББЖЗШ§КХзюКѓвЛПХШЋЧђзщЭјЮРаЧГЩЙІЗЂЩфЃЁжДааБОДЮЗЂЩфШЮЮёЕФГЄШ§ввдЫдиЛ№М§МгзАЕФГЃЙцШМСЯЮЊЦЋЖўМзыТЃЈC2H8N2ЃЉКЭЫФбѕЛЏЖўЕЊЁЃЦЋЖўМзыТКЭЫФбѕЛЏЖўЕЊвВПЩвдзїЮЊШМСЯЕчГиЕФСНМЋЗДгІЮяЁЃЖўепЗДгІЕФВњЮяОљЖдЛЗОГВЛВњЩњЮлШОЁЃИљОнвдЩЯаХЯЂХаЖЯЯТСаЫЕЗЈе§ЮѓЃК
ЂйЦЋЖўМзыТЪЧгаЛњЮяЃЌЦфжаЕЊдЊЫиЛЏКЯМлЮЊ-3_____
ЂкЩњГЩ1molCO2зЊвЦ8molЕчзг_____
ЂлЦЋЖўМзыТгыЫФбѕЛЏЖўЕЊЕФЗДгІЪЧЗХШШЗДгІ_____
ЂмИУШМСЯЕчГижаЦЋЖўМзыТЪЧИКМЋЗДгІЮя_____
ЃЈ2ЃЉШчЭМЫљЪОзАжУЃЌгУЩњГЩЕФТШЦјгыввЖўШЉжЦБИввЖўЫсЃЌЗДгІдРэЮЊ![]() ЃЋ2Cl2ЃЋ2H2OЁњ
ЃЋ2Cl2ЃЋ2H2OЁњ![]() ЃЋ4HClЁЃ
ЃЋ4HClЁЃ
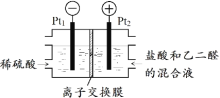
ХаЖЯвдЯТЫЕЗЈЕФе§ЮѓЃК
ЂнИУзАжУРћгУЩЯЪіЗДгІНЋЕчФмШЋВПзЊЛЏЮЊЛЏбЇФм_____
ЂоPt1ЕчМЋЕФЗДгІЪНЮЊ2H2OЃЋ2e-=H2ЁќЃЋ2OH-_____
ЂпбЮЫсГ§діЧПШмвКЕМЕчадЕФзїгУЃЌЛЙЬсЙЉCl-ВЮгыЕчМЋЗДгІ_____
ЂрРэТлЩЯУПЕУЕН0.1molввЖўЫсЃЌНЋга0.4molH+ДггвЪвЧЈвЦЕНзѓЪв_____
ЃЈ3ЃЉХаЖЯЖдЯТСаЭМЯёЕФУшЪіЕФе§ЮѓЃК
ЂсИљОнЭМaПЩХаЖЯЗДгІA2(g)ЃЋ3B2(g)![]() 2AB3(g)ЕФІЄHЃО0_____
2AB3(g)ЕФІЄHЃО0_____
ЂтЭМbПЩБэЪОбЙЧПЃЈPЃЉЖдЗДгІ2A(g)ЃЋ2B(g)![]() 3C(g)ЃЋD(s)ЕФгАЯь_____
3C(g)ЃЋD(s)ЕФгАЯь_____
ЭМcПЩБэЪОЯђДзЫсШмвКЭЈШыАБЦјЪБЃЌШмвКЕМЕчадЫцАБЦјСПЕФБфЛЏ_____
ИљОнЭМdЃЌГ§ШЅCuSO4ШмвКжаЕФFe3+ЃЌПЩМгШыNaOHЕїНкpHжС3~4_____
ЃЈ4ЃЉРћгУШчЯТЪЕбщЬНОПЬњЖЄдкВЛЭЌШмвКжаЕФЮќбѕИЏЪДЁЃ
ЪЕбщзАжУ | ЪЕбщБрКХ | НўХнвК | pH | бѕЦјХЈЖШЫцЪБМфЕФБфЛЏ |
| i | H2O | 7 |
|
ii | 1.0molЁЄL-1NH4Cl | 5 | ||
iii | 0.5molЁЄL11(NHspan>4)2SO4 | 5 | ||
iv | 1.0molЁЄL-1NaCl | 7 | ||
v | 0.5molЁЄL-1Na2SO4 | 7 |
ЭЈЙ§вдЩЯЪЕбщХаЖЯЯТСаЫЕЗЈе§ЮѓЃК
iгыivЁЂvБШНЯЫЕУїбЮШмвКПЩвдМгПьЮќбѕИЏЪДЫйТЪ_____
iiгыiiiЁЂivгыvБШНЯЫЕУїЮќбѕИЏЪДЫйТЪгывѕРызгжжРрЮоЙи_____
ЯђЪЕбщvШмвКжаМгШыЩйСП(NH4)2SO4ЙЬЬхЃЌЮќбѕИЏЪДЫйТЪМгПь_____
ЯђЪЕбщiiШмвКжаМгЕШЬхЛ§ЕФ0.5molЁЄL-1(NH4)2SO4ЃЌЮќбѕИЏЪДЫйТЪвЛЖЈМгПь_____
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввЯЉЦјЯржБНгЫЎКЯЗДгІжЦБИввДМЃКC2H4(g)+H2O(g) ![]() C2H5OH(g)ЁЃввЯЉЕФЦНКтзЊЛЏТЪЫцЮТЖШЁЂбЙЧПЕФБфЛЏЙиЯЕШчЯТЃЈЦ№ЪМЪБЃЌn(H2O)ЃНn(C2H4)ЃН1 molЃЌШнЦїЬхЛ§ЮЊ1 LЃЉЁЃЯТСаЗжЮіВЛе§ШЗЕФЪЧЃЈ ЃЉ
C2H5OH(g)ЁЃввЯЉЕФЦНКтзЊЛЏТЪЫцЮТЖШЁЂбЙЧПЕФБфЛЏЙиЯЕШчЯТЃЈЦ№ЪМЪБЃЌn(H2O)ЃНn(C2H4)ЃН1 molЃЌШнЦїЬхЛ§ЮЊ1 LЃЉЁЃЯТСаЗжЮіВЛе§ШЗЕФЪЧЃЈ ЃЉ
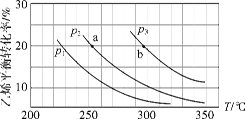
A.ввЯЉЦјЯржБНгЫЎКЯЗДгІЕФHЃМ0
B.ЭМжабЙЧПЕФДѓаЁЙиЯЕЮЊЃКp1ЃОp2ЃОp3
C.ЭМжаaЕуЖдгІЕФЦНКтГЃЪ§K ЃН![]()
D.ДяЕНЦНКтзДЬЌaЁЂbЫљашвЊЕФЪБМфЃКaЃОb
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЭЌбЇдкЪЕбщЪвНјааЬњбЮгыбЧЬњбЮЯрЛЅзЊЛЏЪЕбщЁЃ
ЪЕбщЂёЃКНЋFe3+зЊЛЏЮЊFe2+

(1)Fe3+гыCuЗлЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ_________________________________ЁЃ
(2)ФГбЇЩњгУЖдБШЪЕбщЗЈЬНОПАзЩЋГСЕэВњЩњЕФдвђЃЌЧыЬюаДЪЕбщЭђАИЃК
ЪЕбщЗНАИ | ЯжЯѓ | НсТл |
ВНжш1ЃКШЁ4mLЂй__________ mol/LCuSO4ШмвК,ЯђЦфжаЕЮМг3ЕЮ0.1mol/LKSCNШмвК | ВњЩњАзЩЋГСЕэ | CuSO4ШмвКгыKSCNШмвКЗДгІВњЩњСЫАзЩЋГСЕэ |
ВНжш2ЃКШЁ4mLЂк__________mol/LFeSO4 ШмвКЯђЦфжаЕЮМг3ЕЮ0.1mol/LKSCNШмвК | ЮоУїЯдЯжЯѓ |
ВщдФзЪСЯЃК
вбжЊЃКЂйSCN-ЕФЛЏбЇаджЪгыI-ЯрЫЦ Ђк2Cu2++4I-=2CuIЁ§+I2
Cu2+гыSCN-ЗДгІЕФРызгЗНГЬЪНЮЊЂл___________________________________ЁЃ
ЪЕбщЂђЃКНЋFe2+зЊЛЏЮЊFe3+
ЪЕбщЗНАИ | ЯжЯѓ |
Яђ3mL0.1mol/LFeSO4ШмвКжаМгШы3mL0.5mol/LЯЁЯѕЫс | ШмвКБфЮЊзиЩЋЃЌЗХжУвЛЖЮЪБМфКѓЃЌзиЩЋЯћЪЇЃЌШмвКБфЮЊЛЦЩЋ |
ЬНОПЩЯЪіЯжЯѓГіЯжЕФдвђЃК
ВщдФзЪСЯЃКFe2++NO![]() Fe(NO)2+(зиЩЋ)
Fe(NO)2+(зиЩЋ)
(3)гУРызгЗНГЬЪННтЪЭNOВњЩњЕФдвђ___________________________________ЁЃ
(4)ДгЛЏбЇЗДгІЫйТЪгыЯоЖШЕФНЧЖШЖдЬхЯЕжаДцдкЕФЗДгІНјааЗДгІЂёЃКFe2+гыHNO3ЗДгІЃЛЗДгІЂђЃКFe2+гыNOЗДгІЁЃЧыгУЛЏбЇЦНКтвЦЖЏдРэНтЪЭШмвКгЩзиЩЋБфЮЊЛЦЩЋЕФдвђ_____________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђ20 mL NaOHШмвКжаж№ЕЮМгШы0.1 mol/LДзЫсШмвКЃЌЕЮЖЈЧњЯпШчЭМЫљЪОЁЃЯТСаХаЖЯе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ

A.дкMЕуЃЌСНепЧЁКУЗДгІЭъШЋ
B.ЕЮЖЈЧАЃЌЫсжаcЃЈH+ЃЉ ЕШгкМюжаcЃЈOHЉЃЉ
C.NaOHШмвКЕФЮяжЪЕФСПХЈЖШЮЊ0.1 mol/L
D.дкNЕуЃЌШмвКжаЕФcЃЈCH3COOЉЃЉЃНcЃЈCH3COOHЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГСђЫсУОКЭСђЫсТСЕФЛьКЯШмвКжаЃЌc(Mg2+ )ЃН2 molЁЄLЃ1ЃЌc(SO42-)ЃН6.5 molЁЄLЃ1ЃЌШєНЋ200 mLДЫЛьКЯвКжаЕФMg2ЃЋКЭAl3ЃЋЗжРыЃЌжСЩйгІМгШы1.6 molЁЄLЃ1ЧтбѕЛЏФЦШмвКЕФЬхЛ§ЪЧ
AЃЎ0.5 L BЃЎ1.625 LCЃЎ1.8 LDЃЎ2 L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКуЮТЯТЃЌЮяжЪЕФСПжЎБШЮЊ2ЁУ1ЕФSO2КЭO2ЕФЛьКЯЦјЬхдкШнЛ§ЮЊ2 LЕФКуШнУмБеШнЦїжаЗЂЩњЗДгІЃК2SO2(g)ЃЋO2(g)![]() 2SO3(g)(е§ЗДгІЮЊЗХШШЗДгІ)ЃЌn(SO2)ЫцЪБМфБфЛЏЙиЯЕШчЯТБэЃК
2SO3(g)(е§ЗДгІЮЊЗХШШЗДгІ)ЃЌn(SO2)ЫцЪБМфБфЛЏЙиЯЕШчЯТБэЃК
ЪБМф/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
A. ЕБШнЦїжаЦјЬхЕФУмЖШВЛБфЪБЃЌИУЗДгІДяЕНЦНКтзДЬЌ
B. ИУЗДгІНјааЕНЕк3ЗжжгЪБЃЌФцЗДгІЫйТЪаЁгке§ЗДгІЫйТЪ
C. ДгЗДгІПЊЪМЕНДяЕНЦНКтЃЌгУSO3БэЪОЕФЦНОљЗДгІЫйТЪЮЊ0.01 mol/(LЁЄmin)
D. ШнЦїФкДяЕНЦНКтзДЬЌЪБЕФбЙЧПгыЦ№ЪМЪБЕФбЙЧПжЎБШЮЊ5ЁУ4
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com