
| A. | 2.24LNH3和CH4的混合气体,所含电子总数为2NA | |
| B. | 1mol乙醇(CH3CH2OH)分子中含有共价键总数为8NA | |
| C. | 1mol/LNa2CO3溶液中,含有CO32-离子数为NA | |
| D. | 6.4gCu与足量浓硝酸反应,用排水法收集的气体分子数为0.2NA |
分析 A、气体所处的状态不明确;
B、乙醇中含8条共价键;
C、溶液体积不明确;
D、求出铜的物质的量,然后根据铜和浓硝酸反应后将浓硝酸还原为NO2来分析.
解答 解:A、气体所处的状态不明确,故无法计算气体的物质的量和电子个数,故A错误;
B、乙醇中含8条共价键,故1mol乙醇中含8mol共价键即8NA个,故B正确;
C、溶液体积不明确,故溶液中的碳酸根的个数无法计算,故C错误;
D、6.4g铜的物质的量为0.1mol,而铜和浓硝酸反应后将浓硝酸还原为0.2molNO2,而用排水法收集时0.2mol二氧化氮和水反应生成NO,故分子数小于0.2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:多选题
| 温度℃ | 400 | 500 | 830 | 1000 |
| 平均常数K | 10 | 9 | 1 | 0.6 |
| A. | 上述反应中正反应是吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{\{c({H}_{2})•c(C{O}_{2})\}}{\{c(CO)•c({H}_{2}O)\}}$ | |
| C. | 该反应在400℃时达平衡状态,若升高温度,则正反应速率减小,逆反应速率增大 | |
| D. | 在830℃,2L的密闭容器中,冲入1molCO、5molH2O(g)、3molCO2和2molH2发生上述反应,在达到平衡前V(正)<V(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
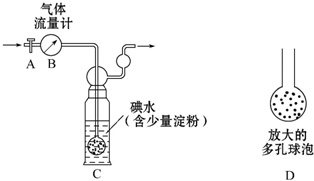
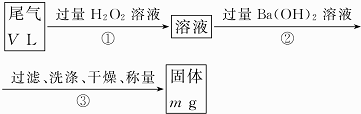
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
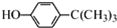 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: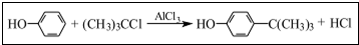 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.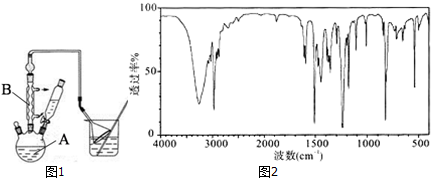
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
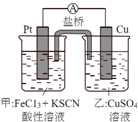
| A. | 该原电池的正极反应是Cu2++2e-=Cu | |
| B. | 甲烧杯中溶液的血红色逐渐变浅 | |
| C. | 盐桥中的SO42-流向甲烧杯 | |
| D. | 若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
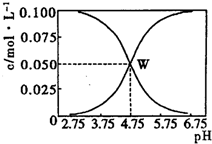 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )| A. | 由题给图示可求出25℃时醋酸的电离平衡常数Ka=10-4.75 | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH))+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大O2的浓度能加快反应速率 | B. | 降低体系温度能加快反应速率 | ||
| C. | 使用催化剂不影响反应速率 | D. | 一定条件下SO2能100%转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水代替碘水进行萃取实验 | |
| B. | 用过量的氯气进行性质实验 | |
| C. | 用乙烯和氧气在银作催化剂的条件下制备环氧乙烷 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸反应的实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com